题目内容
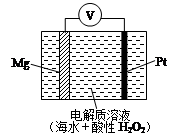
 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁-过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁-过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )分析:该燃料电池中,镁作负极,铂作正极,负极上镁失电子发生氧化反应,正极上双氧水得电子生成水.
解答:解:A.该燃料电池中,镁作负极,负极上镁失电子发生氧化反应,电极反应式为:Mg-2e-=Mg2+,故A正确;
B.铂作正极,正极上双氧水得电子发生还原反应而生成水,故B正确;
C.原电池放电时,电解质溶液中阳离子向正极移动,所以氢离子向正极移动,故C错误;
D.原电池正极上双氧水得电子生成水,溶液中氢离子浓度降低,所以溶液的pH增大,故D正确;
故选C.
B.铂作正极,正极上双氧水得电子发生还原反应而生成水,故B正确;
C.原电池放电时,电解质溶液中阳离子向正极移动,所以氢离子向正极移动,故C错误;
D.原电池正极上双氧水得电子生成水,溶液中氢离子浓度降低,所以溶液的pH增大,故D正确;
故选C.
点评:本题考查原电池原理,明确正负极上得失电子是解本题关键,知道原电池放电时电解质溶液中阴阳离子的移动方向,为易错点.

练习册系列答案
相关题目
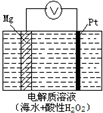
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁—过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是
| A.电池的负极反应为:Mg – 2e-= Mg2+ |
| B.电池工作时,H+向负极移动 |
| C.电池工作一段时间后,溶液的pH增大 |
| D.电池总反应是:Mg + H2O2 + 2H+= Mg2++ 2H2O |

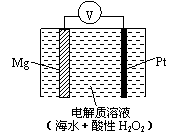 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁—过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁—过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是