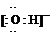题目内容
在密闭容器中,保持一定温度进行如下反应:N2(g)+3H2(g)?2NH3(g),已知加入1mol N2和3mol H2,在恒压条件下达到平衡时生成amol NH3,若在恒容条件下达到平衡时生成b mol NH3.若相同条件下,达到平衡时混合物中各组分的质量分数不变.回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=
.
(2)平衡常数K值越大,表明建立平衡时
A.N2的转化率越高 B.NH3的产量越大
C.正反应进行得越彻底 D.化学反应速率越快
(3)a与b的关系是:a
(4)填写下表:
(1)写出该反应的化学平衡常数表达式:K=
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
(2)平衡常数K值越大,表明建立平衡时
ABC
ABC
(填序号).A.N2的转化率越高 B.NH3的产量越大
C.正反应进行得越彻底 D.化学反应速率越快
(3)a与b的关系是:a
>
>
b(填“>”“<”或“=”).(4)填写下表:
| 状态 条件 |
起始时物质的物质的量(mol) | 平衡时NH3的物质的量(mol) | |||
| 编号 | X(N2) | Y(H2) | Z(NH3) | ||
| 恒压 | ① | 1 | 3 | 0 | a |
| ② | 2.25 | a | |||
| ③ | 2 | 3a | |||
分析:(1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
(2)根据平衡常数的表达式可知,平衡常数K值越大,生成物的产量越大,反应物转化率越高;
(3)恒压条件下反应,与恒容条件相比,恒压下的压强大于恒容时的压强,平衡向着正向移动;
(4)由于恒压条件下,反应物转化率相等,各组分的百分比相同,据此进行分析.
(2)根据平衡常数的表达式可知,平衡常数K值越大,生成物的产量越大,反应物转化率越高;
(3)恒压条件下反应,与恒容条件相比,恒压下的压强大于恒容时的压强,平衡向着正向移动;
(4)由于恒压条件下,反应物转化率相等,各组分的百分比相同,据此进行分析.
解答:解:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,应为K=故答案为:K=
,故答案为:
;
(2)根据K=
分析,平衡常数K值越大,生成物的产量越大,反应物的转化率越高,正反应进行的越彻底,故ABC正确,故选ABC;
(3)由于该反应是体积减小的反应,恒压时的压强大于恒容条件下的压强,压强增大,平衡向着正向移动,所以a>b,故答案为:>;
(4)根据反应N2(g)+3H2(g)?2NH3(g),恒压条件下,反应物的转化率相同,所以根据氨气的物质的量确定需要氮气、氢气的物质的量,
②达到平衡时,氨气物质的量与①相同,所以按照化学计量数转化成氮气、氢气,物质的量与①的相等,即1mol氮气、3mol氢气;氢气的物质的量是2.25mol,比①少0.75mol,需要氨气补充,氨气的物质的量为:0.75mol×
=0.50mol,氮气的物质的量就等于氢气的
,即2.25mol×
=0.75mol,
故答案为:0.75;0.5;
③氨气的物质的量为3a,相当于需要氮气3mol、氢气9mol,现在有氨气2mol,相当于有氮气2mol、氢气6mol,所以还需要氮气1mol,氢气3mol,
故答案为:1;3.
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
(2)根据K=
| [NH3]2 |
| [N2][H2]3 |
(3)由于该反应是体积减小的反应,恒压时的压强大于恒容条件下的压强,压强增大,平衡向着正向移动,所以a>b,故答案为:>;
(4)根据反应N2(g)+3H2(g)?2NH3(g),恒压条件下,反应物的转化率相同,所以根据氨气的物质的量确定需要氮气、氢气的物质的量,
②达到平衡时,氨气物质的量与①相同,所以按照化学计量数转化成氮气、氢气,物质的量与①的相等,即1mol氮气、3mol氢气;氢气的物质的量是2.25mol,比①少0.75mol,需要氨气补充,氨气的物质的量为:0.75mol×
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
故答案为:0.75;0.5;
③氨气的物质的量为3a,相当于需要氮气3mol、氢气9mol,现在有氨气2mol,相当于有氮气2mol、氢气6mol,所以还需要氮气1mol,氢气3mol,
故答案为:1;3.
点评:本题考查化学平衡移动问题,涉及平衡常数、反应速率、平衡标志等问题,题目难度中等,注意解题方法和技巧的积累.

练习册系列答案
相关题目
 X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成.X有5个原子核.通常状况下,W为无色液体.已知:X+Y
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成.X有5个原子核.通常状况下,W为无色液体.已知:X+Y