题目内容
配制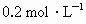 的NaOH溶液500mL.
的NaOH溶液500mL.
(1)需要使用的主要仪器有______、________、_____、_______、_______.
(2)需NaOH固体___________g.
(3)下列是某同学的操作过程(到定容为止):
A.在托盘天平的两个托盘上各放一张大小相等的白纸,称出所需NaOH固体;
B.将所称NaOH固体放入烧杯中加入约50mL蒸馏水,用玻璃棒搅拌,使其溶解,静置冷却;
C.将溶液由烧杯倒入500mL容量瓶中;
D.往容量瓶中小心加蒸馏水,直到液面接近刻度1cm~2cm处;
E.改用胶头滴管加蒸馏水,使溶液凹面最低点恰好与刻度相切,把容量瓶盖紧,再振荡摇匀.
①上述操作中错误的步骤是____________.
②应该增加的操作是___________.
(4)下列操作会使所配溶液浓度偏低的是_____________.
A.称量NaOH固体时间太长
B.NaOH固体溶解后未冷却就移液定容
C.定容后摇匀,发现液面又低于刻度线,然后补加蒸馏水至刻度线
D.仰视定容
答案:略
解析:
解析:
|
(1) 托盘天平;烧杯;玻璃棒;500mL容量瓶;胶头滴管(2)4.0g (3) ①AC②用蒸馏水洗涤烧杯内壁和玻璃棒 2~3次,把洗涤液沿玻璃棒注入容量瓶(4)ACD |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 实验室要配制0.5mol/L的NaOH溶液100mL,则:
实验室要配制0.5mol/L的NaOH溶液100mL,则: