题目内容
A、B、C、D四种短周期元素的原子序数依次增大,A的氢化物的化学式为H2A,1 mol B与水反应可以生成0.5 mol氢气,C原子最外层有 4个电子,D元素原子核外最外层比次外层少1个电子。由此可以判断(写元素符号):A为_____________,B为_____________,C为_____________,D为_____________。
解析:A为-2价,为氧或硫;B为+1价,短周期内只能是钠,则确定A为氧;按原子序数依次增大,则C为硅,不是碳;D原子核外电子排布为![]() 或
或![]() ,依据原子序数增大,D应为氯。
,依据原子序数增大,D应为氯。
答案:O Na Si Cl

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比3:4,D分别与A、B、C可形成10个电子的分子X、Y、Z.则下列叙述正确的是( )
| A、X、Y、Z三种分子的稳定性逐渐减弱 | B、上述四种元素共能形成五种单质 | C、X、Y、Z三种分子的沸点逐渐升高 | D、X、Y、Z三种分子均为极性分子 |

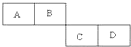 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.