题目内容
在化学分析实验中,常常用到酸碱滴定、沉淀滴定、氧化还原滴定等。下列属于氧化还原滴定的是( )
A.用标准盐酸滴定NaOH溶液
B.用标准KMnO4溶液滴定FeSO4溶液
C.用标准KSCN溶液滴定FeCl3溶液
D.用标准AgNO3溶液滴定NaCl溶液
B
【解析】A项属于酸碱中和滴定;B项属于氧化还原滴定;C项中SCN-与Fe3+发生络合反应,生成血红色溶液,滴定过程中没有发生氧化还原反应;D项属于沉淀滴定。

 习题精选系列答案
习题精选系列答案为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。(固定装置已略去)
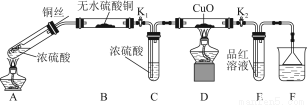
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是 __。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为 _。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)