题目内容
9.A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: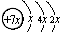 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的名称:ASi DN
(2)画出D基态原子的核外电子轨道表示式

(3)用化学式表示上述五种元素中碱性最强的是NaOH.
(4)A、B、C、D电负性由小到大排列的顺序为Na<Si<P<N<F(写元素符号).
(5)D的氢化物分子的结构式为
 ,其中心原子D的杂化方式为sp3.
,其中心原子D的杂化方式为sp3.(6)E元素位于周期表的第四周期第Ⅷ族族.
分析 A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
解答 解:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,故C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,则E为Fe元素.
(1)由上述分析可知,A为Si元素、D为N元素,故答案为:Si;N;
(2)D为N元素,原子核外电子排布为1s22s22p3,核外电子轨道表示式为 ,故答案为:
,故答案为: ;
;
(3)上述5种元素中,Na的金属性最强,故NaOH的碱性最强,故答案为:NaOH;
(4)周期自左而右电负性增大、同主族自上而下电负性增大,故电负性:Na<Si<P<N<F,故答案为:Na<Si<P<N<F;
(5)D的氢化物为NH3,分子的结构式为 ,其中心N原子呈3个σ键,含有一对孤电子对,杂化轨道数目为4,故N原子的杂化方式为sp3,
,其中心N原子呈3个σ键,含有一对孤电子对,杂化轨道数目为4,故N原子的杂化方式为sp3,
故答案为: ;sp3;
;sp3;
(6)E为Fe元素,在周期表中处于第四周期第Ⅷ族,故答案为:四、Ⅷ族.
点评 本题是对物质结构的考查,涉及核外电子排布、元素周期律、电负性、杂化轨道等,难度不大,有利于基础知识的巩固.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
20.下列有机物分子中有三种不同的氢原子,且氢原子个数之比为3:2:1的是( )
| A. | CH3CHO | B. | CH3COOC2H5 | C. | CH3COOH | D. | CH3CH2OH |
17.下列离子方程式正确的是( )
| A. | 向盐酸中滴加氨水:H++OH-=H2O | |
| B. | Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| D. | Na2SO3溶液中加入稀硝酸:SO32-+2H+=SO2↑+H2O |
4. 按要求回答下列各题:
按要求回答下列各题:
(1)现有六种物质:①干冰;②金刚石;③四氯化碳;④氯化钙;⑤二氧化硅;⑥硫酸镁.请用编号填写下列空白:
(Ⅰ)熔化时需要破坏共价键的化合物是⑤
(Ⅱ)属于分子晶体且分子空间构型为直线型的是①,其电子式为
(Ⅲ)含有共价键的离子化合物是⑥.
(2)短周期中金属性最强的元素是Na(填元素符号);画出周期表中第三周期第VA族元素原子的结构示意图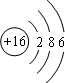 ;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
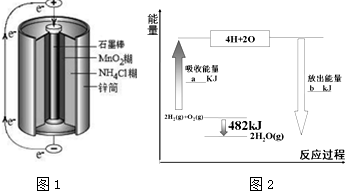
(3)锌锰干电池是最早使用的化学电源,其基本构造如图1所示.该电池的负极材料是Zn,若电路中通过0.4mole-,负极质量减少13g.工作时NH4+在正极放电产生两种气体,其中一种气体分子含10e-的微粒,正极的电极反应式为2NH4++2e-═2NH3↑+H2↑.
(4)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
根据图2中能量变化图,回答下列问题:
①图中:a=1370. ②表格中:X=463.
 按要求回答下列各题:
按要求回答下列各题:(1)现有六种物质:①干冰;②金刚石;③四氯化碳;④氯化钙;⑤二氧化硅;⑥硫酸镁.请用编号填写下列空白:
(Ⅰ)熔化时需要破坏共价键的化合物是⑤
(Ⅱ)属于分子晶体且分子空间构型为直线型的是①,其电子式为

(Ⅲ)含有共价键的离子化合物是⑥.
(2)短周期中金属性最强的元素是Na(填元素符号);画出周期表中第三周期第VA族元素原子的结构示意图
 ;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)
;第三周期元素中,形成简单离子半径最小的是Al3+(填离子符号)(3)锌锰干电池是最早使用的化学电源,其基本构造如图1所示.该电池的负极材料是Zn,若电路中通过0.4mole-,负极质量减少13g.工作时NH4+在正极放电产生两种气体,其中一种气体分子含10e-的微粒,正极的电极反应式为2NH4++2e-═2NH3↑+H2↑.
(4)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能.下表是某些共价键的键能:
| 共价键 | H-H | O=O | H-O |
| 键能/kJ•mol-1 | 436 | 498 | X |
①图中:a=1370. ②表格中:X=463.
18.下列各组物质,用一种试剂无法区别的是( )
| A. | 三种浓酸:HNO3、H2SO4、HCl | |
| B. | 四种无色溶液:(NH4)2SO4、NH4Cl、Na2SO4、NaCl | |
| C. | 四种黑色粉末:FeO、Fe、CuO、C | |
| D. | 四种无色溶液:KCl、NaOH、K2SO4、NaNO3 |
19.用NA代表阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 1mol冰中含氢键数为4NA | |
| B. | 12 g金刚石中含有C-C键的个数为4NA | |
| C. | 6 g SiO2晶体中硅氧共价键数为0.2NA | |
| D. | 常温下,100mLmol/LNa2CO3溶液中阴离子总数大于0.1NA |
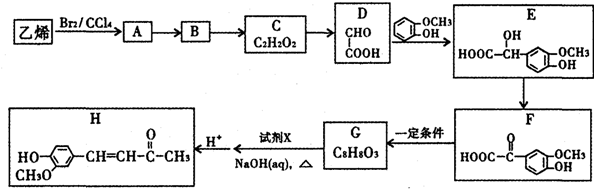
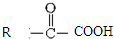 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ 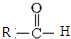 +CO2
+CO2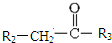 $\stackrel{NaOH(aq),△}{→}$
$\stackrel{NaOH(aq),△}{→}$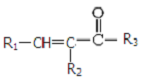 +H2O
+H2O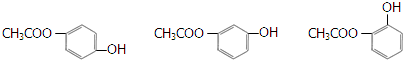 (其中之一).
(其中之一). 某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了实验装置:回答下列问题:
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了实验装置:回答下列问题: .
.