题目内容
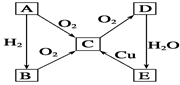
现有X、Y、Z三种非金属元素,A、B、C三种金属元素,有如下情况:
(1)X、Y、Z的单质在常温下均为气体
(2)X的单质在Z的单质中燃烧,火焰呈苍白色。产物XZ的水溶液可使石蕊试液变红。
(3)两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体。
(4)Z的单质溶于X2Y中所得溶液具有漂白性。
(5)A的单质可以在Z的单质中燃烧,生成棕红色固体,该固体溶于水呈黄色溶液。
(6)B与Z形成的化合物BZ3溶于水后逐滴滴加NaOH溶液先生成白色沉淀后又逐渐溶解。
(7)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色固体M。
请完成下列问题:
①写出下列物质的化学式:XZ ,X2Y ,M 。
②Z的单质溶于X2Y中所得溶液中起漂白作用的物质是 (填化学式)
③A的单质与Z的单质反应的化学方程式:
④BZ3与过量的NaOH溶液反应的离子方程式: 。
⑤X单质与Z单质的混合气体经点燃充分反应后,冷却至室温,再通入足量的NaOH溶液中,气体被完全吸收,求原混合气体中X单质与Z单质的体积比可能为 。
①HCl (1分) H2O (1分) Na2O2 (1分) ②HClO (2分)
③2Fe+3Cl2 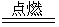 2FeCl3 (2分)
2FeCl3 (2分)
④Al3++4OH- =AlO2- + 2H2O (2分)
V(X) : V(Z) ≦ 1 (3分)
解析试题分析:X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色,XZ易溶于水,XZ的水溶液可使石蕊试液变红,说明X为H元素,Z为Cl元素,形成的化合物为HCl。两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体,应为H2O,则Y为O元素。A的单质可以在Z的单质中燃烧,生成棕红色固体,该固体溶于水呈棕黄色溶液,该棕红色固体为FeCl3,则A为Fe元素。B与Z形成的化合物BZ3溶于水后逐滴滴加NaOH溶液先生成白色沉淀后又逐渐溶解。,BZ3为AlCl3,B为Al。C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色,该淡黄色固体为Na2O2,则C为Na。①由以上分析可知,XZ为HCl,X2Y为H2O,BZ2为CuCl2,淡黄色固体M为Na2O2。②Cl的单质溶于H2O中反应生成HCl和HClO,其中HClO具有漂白性。③Fe在Cl2中燃烧生成,反应的化学方程式为2Fe+3Cl2 2FeCl3。④BZ3与过量的NaOH溶液反应的离子方程式:Al3+ + 4OH- = AlO2- + 2H2O。⑤由于过量的氯气还能发生反应2NaOH+Cl2=NaCl+NaClO+H2O,而氢气不能发生此反应,要保证气体完全被吸收只要确保氢气和氯气的体积比小于等于1就行。
2FeCl3。④BZ3与过量的NaOH溶液反应的离子方程式:Al3+ + 4OH- = AlO2- + 2H2O。⑤由于过量的氯气还能发生反应2NaOH+Cl2=NaCl+NaClO+H2O,而氢气不能发生此反应,要保证气体完全被吸收只要确保氢气和氯气的体积比小于等于1就行。
考点:考查无机物的推断,主要根据物质反应的典型现象作为突破口,学习中注意相关基础知识的积累、总结和归纳。

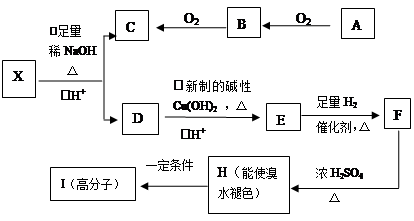
下面是有关物质的转化关系图(部分产物已省略),其中A为单质,E在常温下为液体,D是一种温室气体,C的相对分子质量为78。请回答相关问题。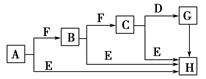
(1)下列对C的结构、性质推断中不正确的是 ( )。
| A.久置于空气中会变成白色 | B.具有强氧化性 |
| C.晶体中存在离子键与非极性键 | D.是一种碱性氧化物 |
(3)C和E反应生成H的离子方程式为__________________,反应中氧化剂与还原剂的物质的量之比为______。