题目内容
(创新)在密闭容器中的可逆反应:CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应放热),在T℃达到平衡后:
CO2(g)+NO(g)(正反应放热),在T℃达到平衡后:
(1)扩大容器体积,平衡________,c(NO2)将________,反应混合物的颜色________.
(2)迅速升高温度至2t℃,达到新的平衡后,体系温度t的范围是________.
(3)加入催化剂,NO的物质的量________,原因是________.
答案:
解析:
解析:
|
答案: (1)不移动 减小 变浅(2)T℃<t<2T℃ (3)不变 催化剂不能使化学平衡发生移动 讲析: |

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
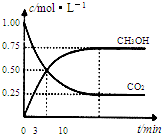 为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1.下列叙述中不正确的是( )
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1.下列叙述中不正确的是( )| A、0~3min内,v(CO2)正=v (CH3OH)正 | B、其他条件不变,若向平衡后的体系中充入1mol氦气,体系压强增大平衡将向正方向移动 | C、在T1℃时,若起始时向容器中充入2molCO2和6mol H2,测得平衡时容器内压强为P2,则 P2<2P1 | D、T2℃时,上述反应平衡常数为4.2,则T2>T1 |

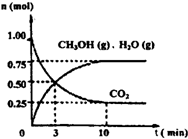 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.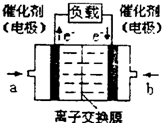
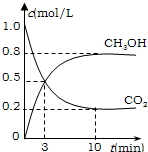 为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.