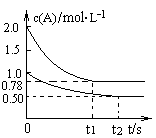题目内容
一定条件下,反应:6H2 + 2CO2 C2H5OH + 3H2O的数据如下图所示。
C2H5OH + 3H2O的数据如下图所示。
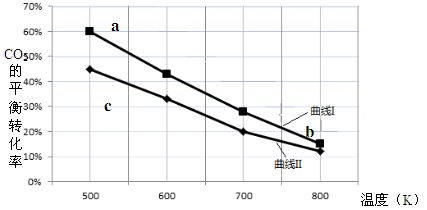

下列说法正确的是
 C2H5OH + 3H2O的数据如下图所示。
C2H5OH + 3H2O的数据如下图所示。

下列说法正确的是
| A.该反应的△H > 0 |
| B.达平衡时,v(H2)正 = v(CO2)逆 |
| C.b点对应的平衡常数K值大于c点 |
| D.a点对应的H2的平衡转化率为90 % |
D
试题分析:A、温度升高,二氧化碳的转化率降低,说明升高温度平衡逆向移动,所以正向为放热反应,该反应的△H <0,错误;B、氢气与二氧化碳的物质的量比是3:1,所以达平衡时,v(H2)正 ="3" v(CO2)逆 ,错误;C、该反应是放热反应,所以升高温度平衡常数K值减小,b点温度高于c点,则b点对应的平衡常数K值小于c点,错误;D、氢气与二氧化碳的物质的量比是3:1,a点的二氧化碳的平衡转化率是60%,曲线I:n(H2):n(CO2)=2,则氢气的平衡转化率是60%×3/2=90%,正确,答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是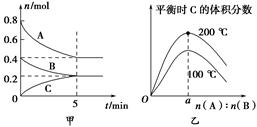
 Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是 
 N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
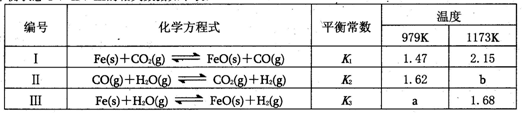
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。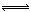 I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是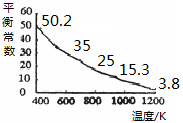
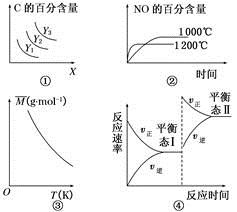
 3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响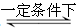 2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是 xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是
xC(g) △H<0,测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是