题目内容
碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.(1)化学与以节能减排为基础的低碳经济密切相关.下列做法违背发展低碳经济的是______(填序号)
A.提高原子利用率,发展绿色化学
B.大力发展汽车产业,鼓励市民购买家用汽车
C.推广煤的气化、液化技术,提供清洁高效燃料
D.开发利用太阳能、风能、氢能、核能等能源
(2)在载人航天器的生态系统中,不仅要求分离除去CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该反应的阳极反应式为:4OH--4e-→O2↑+2H2O,则阴极反应式为______.
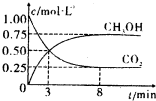
(3)CO2可转化成有机物实现碳循环.在体积为lL的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,
则得CO2和CH2OH(g)的浓度随时间变化如图所示.
①从3min到8min,v(H2)=______.
②能说明上述反应达到平衡状态的是______(填编号).
A.反应中CO2与CH2OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时闻的变化而变化
C.单位时间内每消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(4)已知:
①C(s)+O2(g)═CO2(g),△H1=-437.3kJ?mol-1
②2H2(g)+O2(g)═2H2O(g),△H2=-571.6kJ?mol-1
③2CO(g)+O2(g)═2CO2(g),△H3=-566.0kJ?mol-1
则:C(s)+H2O(g)═CO(g)+H2(g),△H=______.
(5)某文献报道:在30℃、30MPa条件下,以Fe、COCl2作催化剂,CO2和H2反应生成丁烷和戊烷.假定在一容器中充人一定量的CO2和H2,加入催化剂,若CO2和H2的转化率均为100%,产物只有丁烷和戊烷,
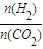 =a,则a的取值范围为______.
=a,则a的取值范围为______.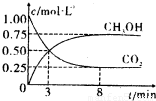
【答案】分析:(1)所谓低碳经济,是指在可持续发展理念指导下,通过技术创新、制度创新、产业转型、新能源开发等多种手段,尽可能地减少煤炭石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态;
(2)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;
(3)①根据v= 计算出v(CH3OH).然后根据速率之比等于化学计量数之比求出v(H2).
计算出v(CH3OH).然后根据速率之比等于化学计量数之比求出v(H2).
②在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理性也不变;
(4)依据题干热化学方程式,结合盖斯定律进行计算;
(5)用极值法,当CO2和H2转化为丁烷或者戊烷时分别求得n(H2)/n(CO2);
解答:解:(1)A.提高原子利用率,发展绿色化学,可以减少污染,符合低碳经济的理念,故A正确;
B.大力发展汽车产业,鼓励市民购买家用汽车,会排放大量的尾气:如二氧化碳等,不符合低碳经济的理念,故B错误;
C.推广煤的气化、液化技术,提供清洁高效燃料,可以减少污染,符合低碳经济的理念,故C正确;
D.开发利用太阳能、风能、氢能、核能等能源,可以减少污染,符合低碳经济的理念,故D正确;
故选:B;
(2)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式:2CO2+4e-+2H2O=2CO+4OH-,
故答案为:2CO2+4e-+2H2O=2CO+4OH-;
(3)①v(CH3OH)=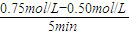 =0.05mol/(L?min),v(H2)=3v(CH3OH)=0.15mol/(L?min),故答案为:0.15mol/(L?min);
=0.05mol/(L?min),v(H2)=3v(CH3OH)=0.15mol/(L?min),故答案为:0.15mol/(L?min);
②A.由图可知反应中CO2与CH3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A错误;
B.因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B错误;
C.无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确.
故选:D;
(4)①C(s)+O2(g)═CO2(g),△H1=-437.3kJ?mol-1
②2H2(g)+O2(g)═2H2O(g),△H2=-571.6kJ?mol-1
③2CO(g)+O2(g)═2CO2(g),△H3=-566.0kJ?mol-1
由盖斯定律,①+②× -③×
-③× ,得C(s)+H2O(g)═CO(g)+H2(g),△H=+131.5kJ?mol-1,
,得C(s)+H2O(g)═CO(g)+H2(g),△H=+131.5kJ?mol-1,
故答案为:+131.5kJ?mol-1;
(5)CO2和H2转化为丁烷,4CO2+13H2 C4H10+8H2O,则
C4H10+8H2O,则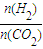 =
= =3.25,
=3.25,
CO2和H2转化为戊烷,5CO2+16H2 C5H12+10H2O,则
C5H12+10H2O,则 =
= =3.2,
=3.2,
故a取值范围为3.2<a<3.25,故答案为:3.2<a<3.25;
点评:本题主要考查了热化学方程式、盖斯定律、电极反应、化学反应速率以及平衡状态的判断等,难度不大,注意知识的积累.
(2)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;
(3)①根据v=
 计算出v(CH3OH).然后根据速率之比等于化学计量数之比求出v(H2).
计算出v(CH3OH).然后根据速率之比等于化学计量数之比求出v(H2).②在一定条件下,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理性也不变;
(4)依据题干热化学方程式,结合盖斯定律进行计算;
(5)用极值法,当CO2和H2转化为丁烷或者戊烷时分别求得n(H2)/n(CO2);
解答:解:(1)A.提高原子利用率,发展绿色化学,可以减少污染,符合低碳经济的理念,故A正确;
B.大力发展汽车产业,鼓励市民购买家用汽车,会排放大量的尾气:如二氧化碳等,不符合低碳经济的理念,故B错误;
C.推广煤的气化、液化技术,提供清洁高效燃料,可以减少污染,符合低碳经济的理念,故C正确;
D.开发利用太阳能、风能、氢能、核能等能源,可以减少污染,符合低碳经济的理念,故D正确;
故选:B;
(2)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式:2CO2+4e-+2H2O=2CO+4OH-,
故答案为:2CO2+4e-+2H2O=2CO+4OH-;
(3)①v(CH3OH)=
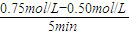 =0.05mol/(L?min),v(H2)=3v(CH3OH)=0.15mol/(L?min),故答案为:0.15mol/(L?min);
=0.05mol/(L?min),v(H2)=3v(CH3OH)=0.15mol/(L?min),故答案为:0.15mol/(L?min);②A.由图可知反应中CO2与CH3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A错误;
B.因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B错误;
C.无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确.
故选:D;
(4)①C(s)+O2(g)═CO2(g),△H1=-437.3kJ?mol-1
②2H2(g)+O2(g)═2H2O(g),△H2=-571.6kJ?mol-1
③2CO(g)+O2(g)═2CO2(g),△H3=-566.0kJ?mol-1
由盖斯定律,①+②×
 -③×
-③× ,得C(s)+H2O(g)═CO(g)+H2(g),△H=+131.5kJ?mol-1,
,得C(s)+H2O(g)═CO(g)+H2(g),△H=+131.5kJ?mol-1,故答案为:+131.5kJ?mol-1;
(5)CO2和H2转化为丁烷,4CO2+13H2
 C4H10+8H2O,则
C4H10+8H2O,则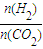 =
= =3.25,
=3.25,CO2和H2转化为戊烷,5CO2+16H2
 C5H12+10H2O,则
C5H12+10H2O,则 =
= =3.2,
=3.2,故a取值范围为3.2<a<3.25,故答案为:3.2<a<3.25;
点评:本题主要考查了热化学方程式、盖斯定律、电极反应、化学反应速率以及平衡状态的判断等,难度不大,注意知识的积累.

练习册系列答案
相关题目
 (2012?枣庄二模)碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(2012?枣庄二模)碳和碳的化合物在人类生产、生活中的应用非常广泛,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.

 所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。
所得Fe(OH)2沉淀暴露在空气中,反应的化学方程式为 。  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:


 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: