题目内容
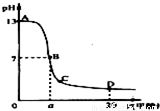
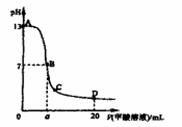
在15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1醋酸溶液,溶液pH和加入的醋酸的体积关系曲线如图所示,有关粒子浓度大小关系正确的是 ( )
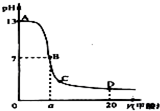
| A.在A、B间任意一点:c(K+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.在B点:c(K+)=c(CH3COO-)>c(OH-)=c(H+),且a=7.5 |
| C.在C点:c(CH3COO-)>c(K+)>c(OH-)>c(H+) |
| D.在D点:c(CH3COO-)+c(CH3COOH)>2c(K+) |

A、在A、B间任意一点,因为开始时c(OH-)>c(CH3COO-),
即也有可能是c(K+)>c(OH-)>c(CH3COO-)>c(H+),故A错误;
B、当恰好中和时消耗0.2mol/L醋酸溶液7.5mL,欲显中性,则有a>7.5,
但此时c(K+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C、C点醋酸过量,溶液呈酸性,c(H+)>c(OH-),故C错误;
D、D点醋酸过量,所加入醋酸的物质的量为0.02L×0.2mol/L═0.004mol,
KOH的物质的量为0.015L×0.1mol/L=0.0015mol,则反应后c(CH3COO-)+c(CH3COOH)>2c(K+),故D正确.
故选D.
即也有可能是c(K+)>c(OH-)>c(CH3COO-)>c(H+),故A错误;
B、当恰好中和时消耗0.2mol/L醋酸溶液7.5mL,欲显中性,则有a>7.5,
但此时c(K+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C、C点醋酸过量,溶液呈酸性,c(H+)>c(OH-),故C错误;
D、D点醋酸过量,所加入醋酸的物质的量为0.02L×0.2mol/L═0.004mol,
KOH的物质的量为0.015L×0.1mol/L=0.0015mol,则反应后c(CH3COO-)+c(CH3COOH)>2c(K+),故D正确.
故选D.

练习册系列答案
相关题目
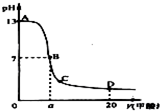 在15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1醋酸溶液,溶液pH和加入的醋酸的体积关系曲线如图所示,有关粒子浓度大小关系正确的是 ( )
在15mL 0.1mol?L-1KOH溶液中逐滴加入0.2mol?L-1醋酸溶液,溶液pH和加入的醋酸的体积关系曲线如图所示,有关粒子浓度大小关系正确的是 ( )