题目内容
研究NO2 、SO2 、CO等大气污染物的处理具有重要意义。NO2可用下列反应来处理:
6 NO2(g)+8NH3(g) 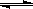 7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。
完成下列填空:
(1)反应的平衡常数大,处理NO2的效率高。增大该反应平衡常数的措施有 。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的是 。
a.c(NO2):c(NH3) = 3:4 b.6v(NO2) = 7v(N2)
c.容器内气体总压强不再变化 d.容器内气体密度不再变化
(3)若平衡时NO2和N2的浓度之比为m/n,保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比 m/n(填“>”、“=”或“<”)。
(4)某温度下,在一个容积为2升的反应容器内,上述反应2分钟后达到平衡,测得刚好有3mol电子发生转移,则在2分钟内NH3的平均反应速率为:
v(NH3) = 。
(1)降低温度(2分)
(2)c(2分)
(3)> (2分)
(4)0.25 mol/(L·min) (1分×2)
【解析】
试题分析:(1)只与温度有关,该反应正反应是放热反应,要增大该反应平衡常数的措施有降低温度。
(2)该反应前后体积发生了变化,所以容器内气体总压强不再变化应做为平衡判断的标志。
(3)保持其它条件不变,缩小反应容器的体积相当于增大了压强,平衡向逆向移动,所以平衡时NO2和N2的浓度之比为m/n大于之前的。
(4)当转移24mol电子时NH3反应了8mol,3mol电子发生转移NH3反应了1mol,根据速率计算公式则在2分钟内NH3的平均反应速率为:v(NH3) = 1/2*2=0.25 mol/(L·min)
考点:考查了平衡移动的影响因素和化学反应速率的计算等

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.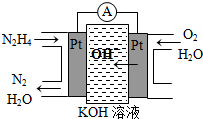 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题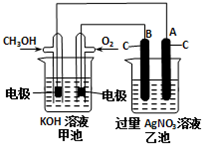 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.