题目内容
已知N2(g)+3H2(g)  2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是
2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是
 2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是
2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是| A.最终可以生成2mol NH3 |
| B.达到化学平衡状态时,正反应和逆反应的速率都为0 |
| C.达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1∶3∶2 |
| D.达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化 |
D
分析:可逆反应不能进行彻底,当达到化学平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不再发生变化,注意反应方程式的前后计量数关系.
解:A.反应为可逆反应,反应物不能完全转化,故A错误;
B.达到化学平衡状态时,正反应和逆反应相等但不为0,故B错误;
C.反应的外界条件不确定,反应物的转化率不确定,则不能确定平衡时各物质的物质的量关系,故C错误;
D.当达到化学平衡状态时,各物质的浓度不再改变,故D正确.
故选D.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
 2 Z(g)+W(g); A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L 。下列说法错误的是
2 Z(g)+W(g); A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L 。下列说法错误的是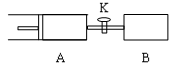
 >v(A)
>v(A)  CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是
CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是 减小
减小 2C(气)+xD(气)+Q经5min达平衡,此时生成2mol C,测得D的平均反应速率为0.1mol·(L·min)-1,下列说法中正确的是
2C(气)+xD(气)+Q经5min达平衡,此时生成2mol C,测得D的平均反应速率为0.1mol·(L·min)-1,下列说法中正确的是 2NH3(g)正反应放热,下列说法错误的是
2NH3(g)正反应放热,下列说法错误的是
 4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是 量分数小于w%
量分数小于w% D(g)+E(g);△H>0 达到平衡后,下列说法中正确的是
D(g)+E(g);△H>0 达到平衡后,下列说法中正确的是