题目内容
(15分)下表为元素周期表的一部分,请参照元素A-K在表中的位置,
请回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_________________________。(用元素符号表示)
(2)B、C、D的第一电离能由大到小的顺序为_________________________。(用元素符号表示)
(3 E、F的最高价氧化物的水化物相互反应的离子方程式_____________________
(4)在B所形成的化合物HCHO、CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有____________;(写结构式,两种)
(5)由A、B、C、D、E元素中某几种组成的10电子微粒子中,含配位键的分子或离子有_________、_________;(写化学式)
(6)由F和K两种元素组成的化合物中,其化学键类型为______________。(填“共价键”或“离子键”),该化合物的二聚体的分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是______________。
| 族 周期 | IA | | 0 | |||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | B | C | D | | |
| 3 | E | | F | G | | | K | |
(1)D、E、F的原子半径由大到小的顺序为_________________________。(用元素符号表示)
(2)B、C、D的第一电离能由大到小的顺序为_________________________。(用元素符号表示)
(3 E、F的最高价氧化物的水化物相互反应的离子方程式_____________________
(4)在B所形成的化合物HCHO、CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有____________;(写结构式,两种)
(5)由A、B、C、D、E元素中某几种组成的10电子微粒子中,含配位键的分子或离子有_________、_________;(写化学式)
(6)由F和K两种元素组成的化合物中,其化学键类型为______________。(填“共价键”或“离子键”),该化合物的二聚体的分子式为Al2Cl6,其结构式为下列四种中的一种,你认为正确的结构是______________。

(15分)(1)Na>Al>O(2分) (2)N>O>C(2分) (3)Al(OH)3+OH-= AlO2-+2H2O
(4)CH4: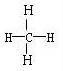 、CH3OH:
、CH3OH: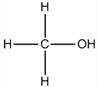 (各1分)
(各1分)
(5)NH4+ H3O+ (各1分) (6)共价键 ③(各2分)
(4)CH4:
 、CH3OH:
、CH3OH: (各1分)
(各1分)(5)NH4+ H3O+ (各1分) (6)共价键 ③(各2分)
(1)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以D、E、F的原子半径由大到小的顺序为Na>Al>O。
(2)非金属性越强,第一电离能越大。但由于氮原子的2p轨道电子处于半充满状态,稳定性强,所以氮原子的大于第一电离能大于氧原子的,即B、C、D的第一电离能由大到小的顺序为N>O>C。
(3)氢氧化铝是两性氢氧化物,能溶于强碱氢氧化钠溶液中,所以 E、F的最高价氧化物的水化物相互反应的离子方程式Al(OH)3+OH-= AlO2-+2H2O。
(4)甲醛是平面型结构,碳原子是sp2杂化,CO是直线型结构,甲烷是正四面体结构,甲醇是四面体结构,碳原子都是sp3杂化,其结构式分别为 、
、 。
。
(5)要形成配位键,必须有提供孤对电子的配体,和接受空轨道的原子或离子。所以含有配位键的是NH4+ H3O+。
(6)氯化铝中含有极性键,属于共价化合物。在该化合物的二聚体中,氯离子是配体,铝原子接受电子,属于答案选③。
(2)非金属性越强,第一电离能越大。但由于氮原子的2p轨道电子处于半充满状态,稳定性强,所以氮原子的大于第一电离能大于氧原子的,即B、C、D的第一电离能由大到小的顺序为N>O>C。
(3)氢氧化铝是两性氢氧化物,能溶于强碱氢氧化钠溶液中,所以 E、F的最高价氧化物的水化物相互反应的离子方程式Al(OH)3+OH-= AlO2-+2H2O。
(4)甲醛是平面型结构,碳原子是sp2杂化,CO是直线型结构,甲烷是正四面体结构,甲醇是四面体结构,碳原子都是sp3杂化,其结构式分别为
 、
、 。
。(5)要形成配位键,必须有提供孤对电子的配体,和接受空轨道的原子或离子。所以含有配位键的是NH4+ H3O+。
(6)氯化铝中含有极性键,属于共价化合物。在该化合物的二聚体中,氯离子是配体,铝原子接受电子,属于答案选③。

练习册系列答案
相关题目

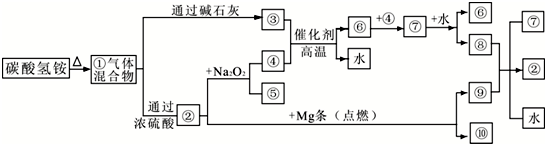
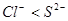 ②
②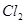 能与
能与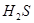 反应生成S
反应生成S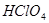 的酸性比
的酸性比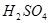 的强 ④常温下
的强 ④常温下