题目内容
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
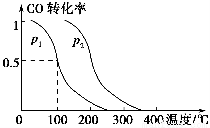
①p1________p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下同),平衡常数________。
(3)已知在T ℃时,CO(g)+H2O(g)??CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是___________________________________________。此时刻v正________v逆(填“>”或“<”)。
(1)CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1 (2)①小于 ②增大 不变 (3)没有 此时
CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1 (2)①小于 ②增大 不变 (3)没有 此时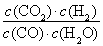 =
=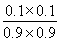 =0.012 3<0.32 >
=0.012 3<0.32 >
【解析】(1)由盖斯定律,热化学方程式①-②得CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=ΔH1-ΔH2=-90 kJ·mol-1-(-41 kJ·mol-1)=-49 kJ·mol-1。(2)由图像可知,相同温度下,p2下CO的转化率大于p1下CO的转化率,由热化学方程式①可知,增大压强平衡右移,故p1<p2;在其他条件不变的情况下,再增加a mol CO与2a mol H2,相当于增大压强,平衡右移,故CO的转化率增大;由于温度不变,故其平衡常数不变。(3)
CH3OH(g)+H2O(g) ΔH=ΔH1-ΔH2=-90 kJ·mol-1-(-41 kJ·mol-1)=-49 kJ·mol-1。(2)由图像可知,相同温度下,p2下CO的转化率大于p1下CO的转化率,由热化学方程式①可知,增大压强平衡右移,故p1<p2;在其他条件不变的情况下,再增加a mol CO与2a mol H2,相当于增大压强,平衡右移,故CO的转化率增大;由于温度不变,故其平衡常数不变。(3)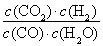 =
=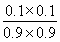 =0.012 3<K=0.32,故反应未达到平衡。此时反应向正反应方向进行,故v正>v逆。
=0.012 3<K=0.32,故反应未达到平衡。此时反应向正反应方向进行,故v正>v逆。