题目内容
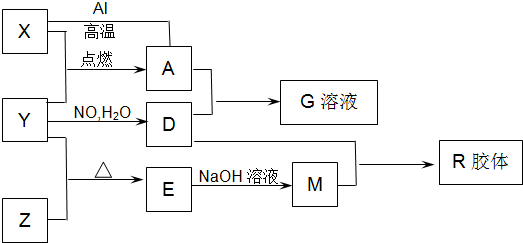
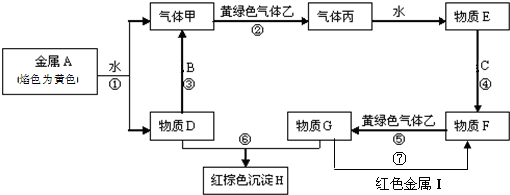
A~J分别表示中学化学中常见的一种物质,它们之间的相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态两性氧化物,A是一种金属单质,F是一种红褐色固体,A、B、C、D、E、F六种物质中均含同一种元素,请填写下列空白:
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中的位置是______.
(2)B的化学式:______,K的电子式:______.
(3)写出④的离子方程式:______.
(4)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH______7(填“>”、“<”或“=”),用离子方程式表示其原因:______.

(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中的位置是______.
(2)B的化学式:______,K的电子式:______.
(3)写出④的离子方程式:______.
(4)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH______7(填“>”、“<”或“=”),用离子方程式表示其原因:______.

G为主族元素的固态两性氧化物,则G是Al2O3,Al2O3和NaOH溶液反应生成NaAlO2和水,电解Al2O3生成铝和氧气,Al也能和NaOH溶液反应,因为I也能和NaOH溶液反应生成J,则I是Al,J是NaAlO2,H是O2;
A是一种金属单质,F是一种红褐色固体,则F是Fe(OH)3,E和氧气反应生成Fe(OH)3,且E和F含有同一种元素,则E是Fe(OH)2,A、B、C、D、E、F六种物质中均含同一种元素,且A为金属单质,根据元素守恒知,A是Fe,铁和水蒸气在高温下发生置换反应生成Fe3O4和氢气,B能和铝发生铝热反应,则B是Fe3O4,Fe3O4和盐酸反应生成FeCl3和FeCl2,C和NaOH反应生成Fe(OH)2,D和NaOH反应生成Fe(OH)3,则C是FeCl2,D是FeCl3,氯化铁溶液和氨气反应生成Fe(OH)3,则K是NH3,
(1)A、B、C、D、E、F六种物质中含有的同一种元素是Fe,铁位于第四周期、第Ⅷ族,
故答案为:第四周期、第Ⅷ族;
(2)通过以上分析知,B是Fe3O4,K是氨气,其电子式为 ,
,
故答案为:Fe3O4; ;
;
(3)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O═2AlO-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO-+3H2↑;
(4)氨气和盐酸反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子易水解而使其溶液呈酸性,则pH<7,
水解离子反应方程式为:NH4++H2O?NH3?H2O+H+,
故答案为:<;NH4++H2O?NH3?H2O+H+.
A是一种金属单质,F是一种红褐色固体,则F是Fe(OH)3,E和氧气反应生成Fe(OH)3,且E和F含有同一种元素,则E是Fe(OH)2,A、B、C、D、E、F六种物质中均含同一种元素,且A为金属单质,根据元素守恒知,A是Fe,铁和水蒸气在高温下发生置换反应生成Fe3O4和氢气,B能和铝发生铝热反应,则B是Fe3O4,Fe3O4和盐酸反应生成FeCl3和FeCl2,C和NaOH反应生成Fe(OH)2,D和NaOH反应生成Fe(OH)3,则C是FeCl2,D是FeCl3,氯化铁溶液和氨气反应生成Fe(OH)3,则K是NH3,
(1)A、B、C、D、E、F六种物质中含有的同一种元素是Fe,铁位于第四周期、第Ⅷ族,
故答案为:第四周期、第Ⅷ族;
(2)通过以上分析知,B是Fe3O4,K是氨气,其电子式为
 ,
,故答案为:Fe3O4;
 ;
;(3)铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O═2AlO-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO-+3H2↑;
(4)氨气和盐酸反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子易水解而使其溶液呈酸性,则pH<7,
水解离子反应方程式为:NH4++H2O?NH3?H2O+H+,
故答案为:<;NH4++H2O?NH3?H2O+H+.

练习册系列答案
相关题目

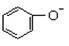 > CO32-> CH3COO-
> CO32-> CH3COO-