题目内容
[化学—物质结构与性质](13分)
(1)元素的第一电离能:Al_Si(填“>”或“<”)。
(2)基态M矿+的核外电子排布式为 。
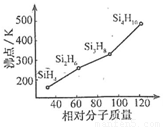
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示
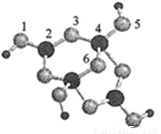
①在Xm-中,硼原子轨道的杂化类型有 ;配位键存在于 原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(1)< (2)1s22s22p63s23p63d5 ([Ar]3d5) (3)硅烷的相对分子质量越大,分子间作用力越强 (4)①sp2、sp3 4,5(或5,4) 2 ②ADE
【解析】(1)同一周期元素自左向右第一电离能有增大趋势,故第一电离能Al<Si。
(2)Mn是25号元素,其电子排布式为1s22s22p63s23p63d54s2,故Mn2+的电子排布式为1s22s22p63s23p63d5。
(3)硅烷形成的晶体是分子晶体,相对分子质量越大,分子间作用力越强,沸点越高。
(4)①由球棍模型可以看出,黑球为B原子,灰球为O原子,小黑球为H原子。2号B原子形成3个键,采取sp2杂化,4号B原子形成4个键,采取sp3杂化;4号B原子三个sp3杂化轨道与除5号外三个O原子形成σ键后还有一个空轨道,而5号O原子能提供孤电子对而形成配位键;由图示可以看出该结构可以表示为[B4H4O9]m-,其中B为+3价,O为-2价,H为+1价,根据化合价可知m=2。
②在晶体中Na+与Xm+之间为离子键,H2O分子间存在范德华力,而该阴离子能与水分子形成氢键。
考点定位:本题综合考查元素第一电离能的变化规律、基态离子核外电子排布、分子晶体熔沸点高低的决定因素、轨道杂化、配位键、微粒间的作用力等,同时考查学生思维能力、图像处理能力、分析物质结构的能力。


 ,平面结构)属于
,平面结构)属于 (2011?锦州模拟)【化学--物质结构与性质】
(2011?锦州模拟)【化学--物质结构与性质】