题目内容
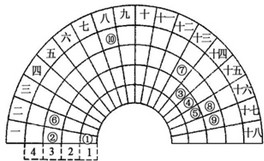 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A、②、⑧、⑨对应简单离子半径依次减小 | B、⑥的氯化物的熔点比⑦的氯化物熔点低 | C、元素⑩处于常见周期表第四周期第VⅢB族 | D、①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
分析:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
B.根据物质的晶体类型分析,离子晶体熔点高于分子晶体;
C.元素⑩处于常见周期表第四周期第VⅢ族;
D.H与C、N、O可以形成C2H2、N2H4、H2O2,分子中都含有极性键、非极性键.
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
B.根据物质的晶体类型分析,离子晶体熔点高于分子晶体;
C.元素⑩处于常见周期表第四周期第VⅢ族;
D.H与C、N、O可以形成C2H2、N2H4、H2O2,分子中都含有极性键、非极性键.
解答:解:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->Na+,故A错误;
B.氯化镁属于离子晶体,而氯化铝属于分子晶体,故氯化镁的熔点更高,故B错误;
C.元素⑩处于常见周期表第四周期第VⅢ族,故C错误;
D.H与C、N、O可以形成C2H2、N2H4、H2O2,分子中都含有极性键、非极性键,故D正确.
故选D.
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->Na+,故A错误;
B.氯化镁属于离子晶体,而氯化铝属于分子晶体,故氯化镁的熔点更高,故B错误;
C.元素⑩处于常见周期表第四周期第VⅢ族,故C错误;
D.H与C、N、O可以形成C2H2、N2H4、H2O2,分子中都含有极性键、非极性键,故D正确.
故选D.
点评:本题考查元素周期表及应用,侧重元素的位置及性质的考查,注意B选项中氯化铝是共价化合物,属于分子晶体.

练习册系列答案
相关题目
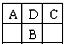 A、B、C为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法错误的是( )
A、B、C为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法错误的是( )| A、A的氧化物有多种形式 | B、B最高价氧化物对应的水化物是一种弱酸 | C、C的氢化物比HCl稳定 | D、D元素形成的单质不止一种 |