题目内容
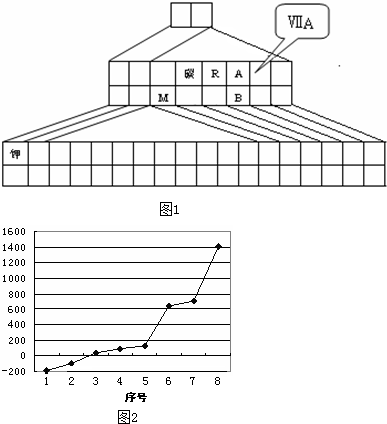
下图是元素周期表的另一种画法--塔式周期表,在上面标有部分族序数及部分元素,请回答下列问题:
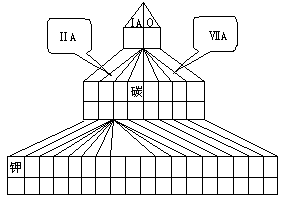
(1)请在图上把VA族涂黑。
(2)短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外 层电子数是其内层电子总数的3倍;C元素与B元素同族;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,试回答:
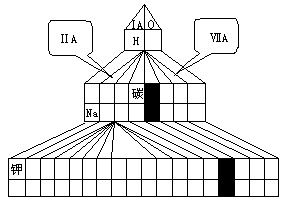
①写出B、C元素的名称:____、____;在塔式周期表相应位置标出D 元素的元素符号。
②写出一种由B、D元素组成的化合物的电子式:____。
③A的固态氧化物属于____晶体(填“分子”“原子”或“离子”)。
④写出C的最高价氧化物的水化物与D的氧化物对应的水化物反应的离子方程式:____。
(3)在上述塔式周期表中列出了5行元素,每行所包含的元素种类分别为2,8,8, 18,18,则未列出的第六行所包含的元素为___种。请根据行数与元素种数的关系,预言第八行最多可能含有________种元素。
(2)短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外 层电子数是其内层电子总数的3倍;C元素与B元素同族;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,试回答:
①写出B、C元素的名称:____、____;在塔式周期表相应位置标出D 元素的元素符号。
②写出一种由B、D元素组成的化合物的电子式:____。
③A的固态氧化物属于____晶体(填“分子”“原子”或“离子”)。
④写出C的最高价氧化物的水化物与D的氧化物对应的水化物反应的离子方程式:____。
(3)在上述塔式周期表中列出了5行元素,每行所包含的元素种类分别为2,8,8, 18,18,则未列出的第六行所包含的元素为___种。请根据行数与元素种数的关系,预言第八行最多可能含有________种元素。
(1)
(2)①氧 ;硫 ;
②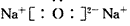 或
或 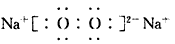
③分子 ;
④H++OH-=H2O
(3)32 ;50

(2)①氧 ;硫 ;
②
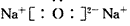 或
或 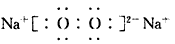
③分子 ;
④H++OH-=H2O
(3)32 ;50

练习册系列答案
相关题目

 中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。
中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。该离子可能具有的化学性质是_________,依据是_______________________________。