题目内容
(1) ②④⑥;100mL容量瓶 玻璃棒;; (2) 5.4;①;(3)偏低;偏高
解析试题分析:(1)配制100 mL 1 mol/L的稀硫酸时,上述仪器中需要使用的有①胶头滴管;③烧杯;⑤量筒,不需要使用的仪器是②烧瓶;④ 药匙;⑥托盘天平。(2)浓硫酸的物质的量浓度是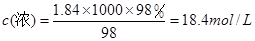 溶液在稀释前后溶质的物质的量不变,18.4mol/L×V= 100ml×1mol/L.解得v= 5.4ml即浓硫酸的体积为5.4ml。量取浓硫酸时应选用规格与量取的体积接近的量筒,选用①10mL规格的量筒;(3)①配制过程中,若将洗涤烧杯所得的溶液直接倒入废液缸中,则会因为溶质的损失导致最后所得溶液的浓度偏低;②定容时俯视容量瓶的刻度线,则由于溶液的体积少所配得的溶液浓度偏高。
溶液在稀释前后溶质的物质的量不变,18.4mol/L×V= 100ml×1mol/L.解得v= 5.4ml即浓硫酸的体积为5.4ml。量取浓硫酸时应选用规格与量取的体积接近的量筒,选用①10mL规格的量筒;(3)①配制过程中,若将洗涤烧杯所得的溶液直接倒入废液缸中,则会因为溶质的损失导致最后所得溶液的浓度偏低;②定容时俯视容量瓶的刻度线,则由于溶液的体积少所配得的溶液浓度偏高。
考点:考查物质的量浓度的溶液的配制使用的仪器的选择、误差分析、与溶液的质量分数的换算的知识。

设NA为阿伏伽德罗常数的值,下列说法中正确的是
| A.常温常压下,11.2L的NO2和CO2混合气体含有NA个O原子 |
| B.标准状况下,22.4L的乙烯中含有的共用电子对数为12NA |
| C.1L0.1mo1·L-1的氨水中含有0.1NA个OH- |
| D.以石墨为电极电解氯化铜溶液时,若阳极上失去电子NA个,则阴极质量增加32g |
下列说法正确的是
| A.4.2 g丙烯中所含的共价键数目为0.6×6.02×1023 |
| B.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023 |
| C.相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 |
| D.相同物质的量OH-和CH3+含有相同数目的电子 |
浓H2SO4密度1.84g/mL,物质的量浓度为18.4 mol/L , 质量分数为98% ,取10mL浓H2SO4和amL水混合得物质的量浓度为Cmol/L,质量分数为b%。下列组合正确的是
(1).若C=9.2则a>10 b>49% (2) 若C=9.2则a>10 b<49%
(3).若b=49则a=18.4 C<9.2 (4) 若b=49则a=18.4 C>9.2
| A.(1) (3) | B.(1) (4) | C.(2) (3) | D.(2) (4) |
用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为 mL的容量瓶。
(2)经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。
| A.5 mL | B.10 mL | C.25 mL | D.50 mL |
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号) 。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是 (填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁和玻璃棒或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是 (填“偏高”、“偏低”或“无影响”)。
 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2C(g)若经过2秒后测得C的浓度为0.6mol/L。