题目内容
标准状况下,将5.6L由CO、CH4、C2H4、C2H2组成的混合气体与18LO2混合于某密闭容器中点燃,反应完成后恢复到原状况,得CO2气体7.50L,则下列判断正确的是 ( )
| A.反应完成后,O2没有剩余 |
| B.原混合气体中,C2H4与C2H2的体积共为1.9L |
| C.反应完成后,生成水的质量为9g |
| D.原混合气体中,CO与CH4的体积比一定为1 :1 |
B
CO2气体O的来源来自CO 和 O2 ,而CO2中的O是7.5×2=15,小于O2的O,18×2=36,故反应完成后,O2有剩余。CO2气体7.50L,C的量是7.5。设CO,CH4为X L,C2H4与C2H2为Y L ,列方程如下,X+Y=5.6(气体的总体积)X+2Y="7.5(" C的守恒 ),解得Y=1.9。B正确。故本题选B。

练习册系列答案
相关题目
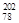 Pt和
Pt和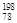 Pt
Pt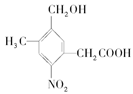 取Na、NaOH和Cu(OH)2分别与等物质的量的A在一定条件下充分反应时,理论上需Na、NaOH和Cu(OH)2三种物质的物质的量之比为
取Na、NaOH和Cu(OH)2分别与等物质的量的A在一定条件下充分反应时,理论上需Na、NaOH和Cu(OH)2三种物质的物质的量之比为