题目内容
(1)金属加工后的废弃液中含2%~5%的NaNO2,它是一种环境污染物.人们用NH4Cl溶液来处理此废弃液,使 NaNO2溶液转化为无毒物质.该反应分两步进行.第一步:NaNO2+NH4Cl═NaCl+NH4NO2,第二步:NH4NO2═N2↑+2H2O.①第一步属于 反应,第二步属于 反应.(填基本反应类型)
②第 步反应是氧化还原反应, 被氧化, 被还原.
③写出该反应的反应总式并用双线桥法标明电子转移的方向和数目 .
(2)①请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式. + → + + +H2O
②反应物中发生氧化反应的物质 ,被还原的元素是 .
③反应中1mol氧化剂 (填“得到”或“失去”) mol电子.
【答案】分析:(1)化合物中的阴阳离子交换成分的反应属于复分解反应,一种化合物生成多种产物的反应是分解反应,有化合价变化的反应是氧化还原反应,化合价降低元素被还原,化合价升高元素被氧化,化合价升高数=化合价降低数=转移电子数;
(2)元素处于最低价具有还原性,元素处于最高价该物质具有氧化性,还原剂发生氧化反应,氧化剂发生还原反应,化合价降低元素被还原.
解答:解:(1)①反应NaNO2+NH4Cl═NaCl+NH4NO2是化合物中的阴阳离子交换成分的反应,属于复分解反应,反应NH4NO2═N2↑+2H2O,是一种反应物生成多种产物的反应,是分解反应,故答案为:复分解;分解;
②反应NH4NO2═N2↑+2H2O有化合价变化,是氧化还原反应,化合价降低的N元素被还原,化合价升高元素的N被氧化,故答案为:二;N;N;
③两个方程式合并即为该反应的反应总式:NaNO2+NH4Cl═NaCl+N2↑+2H2O,化合价升高数=化合价降低数=转移电子数=3,故答案为: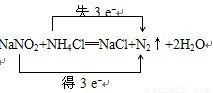 ;
;
(2)①FeSO4中铁元素处于最低价具有还原性,HNO3中N元素处于最高价,具有氧化性,发生的氧化还原反应的表达式为:FeSO4+HNO3→Fe2(SO4)3+Fe(NO3)3+N2O+H2O,故答案为:FeSO4;HNO3;Fe2(SO4)3;Fe(NO3)3;N2O;
②反应中还原剂是FeSO4,发生氧化反应,氧化剂是HNO3,发生还原反应,化合价降低的N元素被还原,故答案为:FeSO4;Fe;
③反应中氧化剂是HNO3,氮元素从+5价降为+1价,得到电子,反应的实质为:8Fe2++10H++2NO3-=8Fe3++N2O↑+5H2O,10mol硝酸参加反应时,转移电子为8mol,所以1mol硝酸参加反应时,转移电子为0.8mol,故答案为:得到;0.8.
点评:本题考查学生氧化还原反应的有关知识,要求学生具有分析和解决问题的能力,难度较大.
(2)元素处于最低价具有还原性,元素处于最高价该物质具有氧化性,还原剂发生氧化反应,氧化剂发生还原反应,化合价降低元素被还原.
解答:解:(1)①反应NaNO2+NH4Cl═NaCl+NH4NO2是化合物中的阴阳离子交换成分的反应,属于复分解反应,反应NH4NO2═N2↑+2H2O,是一种反应物生成多种产物的反应,是分解反应,故答案为:复分解;分解;
②反应NH4NO2═N2↑+2H2O有化合价变化,是氧化还原反应,化合价降低的N元素被还原,化合价升高元素的N被氧化,故答案为:二;N;N;
③两个方程式合并即为该反应的反应总式:NaNO2+NH4Cl═NaCl+N2↑+2H2O,化合价升高数=化合价降低数=转移电子数=3,故答案为:
 ;
;(2)①FeSO4中铁元素处于最低价具有还原性,HNO3中N元素处于最高价,具有氧化性,发生的氧化还原反应的表达式为:FeSO4+HNO3→Fe2(SO4)3+Fe(NO3)3+N2O+H2O,故答案为:FeSO4;HNO3;Fe2(SO4)3;Fe(NO3)3;N2O;
②反应中还原剂是FeSO4,发生氧化反应,氧化剂是HNO3,发生还原反应,化合价降低的N元素被还原,故答案为:FeSO4;Fe;
③反应中氧化剂是HNO3,氮元素从+5价降为+1价,得到电子,反应的实质为:8Fe2++10H++2NO3-=8Fe3++N2O↑+5H2O,10mol硝酸参加反应时,转移电子为8mol,所以1mol硝酸参加反应时,转移电子为0.8mol,故答案为:得到;0.8.
点评:本题考查学生氧化还原反应的有关知识,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
相关题目

 逐渐被空气中的氧气氧化成
逐渐被空气中的氧气氧化成
 离子,如将甲、乙两废液按一定比例混合,毒性明显降低,乙废液中可能含有的离子是
离子,如将甲、乙两废液按一定比例混合,毒性明显降低,乙废液中可能含有的离子是 和
和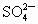
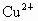 和
和
 和
和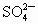
 和
和
 气体,一般用NaOH溶液或氨水吸收,以防污染环境.分别用0.1mol/L的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是
气体,一般用NaOH溶液或氨水吸收,以防污染环境.分别用0.1mol/L的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是 溶液来处理此废切削液,使
溶液来处理此废切削液,使 转化为无毒物质.该反应分两步进行:
转化为无毒物质.该反应分两步进行:

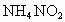 是氧化剂 ②
是氧化剂 ②
 逐渐被空气中的氧气氧化成
逐渐被空气中的氧气氧化成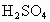
 离子,如将甲、乙两废液按一定比例混合,毒性明显降低,乙废液中可能含有的离子是
离子,如将甲、乙两废液按一定比例混合,毒性明显降低,乙废液中可能含有的离子是 和
和
 和
和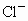
 和
和
 和
和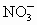
 气体,一般用NaOH溶液或氨水吸收,以防污染环境.分别用0.1mol/L的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是
气体,一般用NaOH溶液或氨水吸收,以防污染环境.分别用0.1mol/L的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收液的体积关系是 溶液来处理此废切削液,使
溶液来处理此废切削液,使 转化为无毒物质.该反应分两步进行:
转化为无毒物质.该反应分两步进行:

 是氧化剂 ②
是氧化剂 ②