题目内容
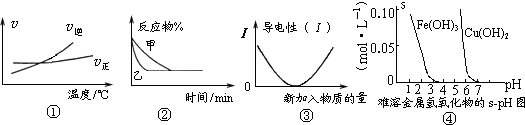
常用图象直观地描述化学反应的进程或结果.下列有关图象的描述正确的是( )


| A、图①可表示温度对“A2(g)+3B2(g)?2AB3(g)△H<0”的影响 | B、图①可表示压强对2A(g)+2B(g)?3C(g)+D(s)的影响 | C、图②可表示醋酸溶液中通入氨气至过量,溶液导电性的变化 | D、图②可表示Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化 |
分析:A、乙到达平衡的时间短,说明乙温度高,因为该反应正反应方向为放热反应,平衡向逆反应方向移动;
B、乙到达平衡的时间短,说明乙压强大,平衡向气体系数减小的方向,即正反应方向移动,反应物的百分含量减小;
C、醋酸溶液中通入氨气至过量,首先醋酸与NH3反应生成强电解质CH3COONH4,溶液导电性增强;
D、Ba(OH)2溶液中滴加稀硫酸,Ba(OH)2与H2SO4反应,生成BaSO4沉淀和H2O,溶液的导电性减弱,完全反应后再加入H2SO4,H2SO4过量,溶液的导电性再逐渐增强.
B、乙到达平衡的时间短,说明乙压强大,平衡向气体系数减小的方向,即正反应方向移动,反应物的百分含量减小;
C、醋酸溶液中通入氨气至过量,首先醋酸与NH3反应生成强电解质CH3COONH4,溶液导电性增强;
D、Ba(OH)2溶液中滴加稀硫酸,Ba(OH)2与H2SO4反应,生成BaSO4沉淀和H2O,溶液的导电性减弱,完全反应后再加入H2SO4,H2SO4过量,溶液的导电性再逐渐增强.
解答:解:A、乙到达平衡的时间短,说明乙温度高,因为该反应正反应方向为放热反应,平衡向逆反应方向移动,反应物的百分含量增大,故A错误;
B、乙到达平衡的时间短,说明乙压强大,平衡向气体系数减小的方向,即正反应方向移动,反应物的百分含量减小,故B错误;
C、醋酸溶液中通入氨气至过量,首先醋酸与NH3反应生成强电解质CH3COONH4,溶液导电性增强,故C错误;
D、Ba(OH)2溶液中滴加稀硫酸,Ba(OH)2与H2SO4反应,生成BaSO4沉淀和H2O,溶液的导电性减弱,完全反应后再加入H2SO4,H2SO4过量,溶液的导电性再逐渐增强,故D正确;
故选D.
B、乙到达平衡的时间短,说明乙压强大,平衡向气体系数减小的方向,即正反应方向移动,反应物的百分含量减小,故B错误;
C、醋酸溶液中通入氨气至过量,首先醋酸与NH3反应生成强电解质CH3COONH4,溶液导电性增强,故C错误;
D、Ba(OH)2溶液中滴加稀硫酸,Ba(OH)2与H2SO4反应,生成BaSO4沉淀和H2O,溶液的导电性减弱,完全反应后再加入H2SO4,H2SO4过量,溶液的导电性再逐渐增强,故D正确;
故选D.
点评:本题考查图象的分析、化学平衡移动、溶液的导电性,学生只要掌握外界条件对化学平衡移动的影响,注意观察图象的关键点,线的走向,就可能迅速解题了.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目