题目内容
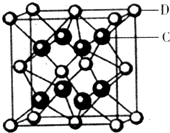
[物质结构与性质]如图所示为血红蛋白和肌红蛋白的活性部分--血红素的结构.
回答下列问题:
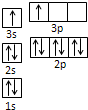
(1)血红素中含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是 ,根据以上电负性请判断H2N-CHO 中C和N的化合价分别为 和 .写出基态Fe原子的核外价电子排布图 .
(2)血红素中两种N原子的杂化方式分别为 ,在图乙的方框内用“→”标出Fe2+的配位键 .
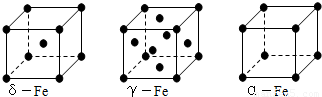
(3)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ,δ、α两种晶胞中铁原子的配位数之比为 ;在δ晶胞中空间利用率为 ,与其具有相同堆积方式的金属还有 (填元素符号).
【答案】分析:(1)根据元素周期表电负性的递变规律比较电负性强弱;H2N-CHO中,N的非金属性比C强,则C、O化合价为负价,H和C为正价,结合化合价代数和为0计算元素的化合价,结合能量最低原理、泡利不相容原理和洪特规则书写电子排布图;
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的 ,若都为单键,则该氮原子为sp3杂化;
,若都为单键,则该氮原子为sp3杂化;
(3)利用均摊法计算晶胞的结构.
解答:解:(1)同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,H的电负性最小,
故有:H<C<N<O,H2N-CHO中,N的非金属性比C强,则C、O化合价为负价,H和C为正价,C的化合价为+2价,N的化合价为-3价,基态Fe原子的核外价电子排布式为[Ar]3d64S2,则基态Fe原子的核外价电子排布图为 ;
;
故答案为:H<C<N<O;+2;+3; ;
;
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的 ,若都为单键,则该氮原子为sp3杂化,如NH4+,
,若都为单键,则该氮原子为sp3杂化,如NH4+,
故答案为:sp2、sp3; ;
;
(3)γ晶体晶胞中所含有的铁原子数为8× +6×
+6× =4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,δ晶胞为体心立方(堆积),空间利用率为68%,为K型,与Na、K、Fe具有相同堆积方式,
=4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,δ晶胞为体心立方(堆积),空间利用率为68%,为K型,与Na、K、Fe具有相同堆积方式,
故答案为:4;4:3;68%;Na、K.
点评:本题考查较为综合,涉及电负性、电子排布图、配位键、杂化方式以及晶胞的计算等问题,题目难度较大,易错点为(3).注意利用均摊法计算晶胞.
(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的
 ,若都为单键,则该氮原子为sp3杂化;
,若都为单键,则该氮原子为sp3杂化;(3)利用均摊法计算晶胞的结构.
解答:解:(1)同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,H的电负性最小,
故有:H<C<N<O,H2N-CHO中,N的非金属性比C强,则C、O化合价为负价,H和C为正价,C的化合价为+2价,N的化合价为-3价,基态Fe原子的核外价电子排布式为[Ar]3d64S2,则基态Fe原子的核外价电子排布图为
 ;
;故答案为:H<C<N<O;+2;+3;
 ;
;(2)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,如NH3.若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化,如本题中的
 ,若都为单键,则该氮原子为sp3杂化,如NH4+,
,若都为单键,则该氮原子为sp3杂化,如NH4+,故答案为:sp2、sp3;
 ;
;(3)γ晶体晶胞中所含有的铁原子数为8×
 +6×
+6× =4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,δ晶胞为体心立方(堆积),空间利用率为68%,为K型,与Na、K、Fe具有相同堆积方式,
=4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3,δ晶胞为体心立方(堆积),空间利用率为68%,为K型,与Na、K、Fe具有相同堆积方式,故答案为:4;4:3;68%;Na、K.
点评:本题考查较为综合,涉及电负性、电子排布图、配位键、杂化方式以及晶胞的计算等问题,题目难度较大,易错点为(3).注意利用均摊法计算晶胞.

练习册系列答案
相关题目

 (2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是