题目内容
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大两个单位,C的质子数比B多4个,1mol A的单质与酸反应,能置换出1g H2,这时A转化为具有与氖原子相同的电子层结构的离子.则A的原子结构示意图为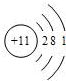
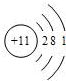 ,B离子的核外电子排布式为
,B离子的核外电子排布式为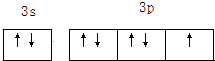
 .
.
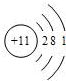
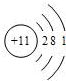
1s22s22p6
1s22s22p6
,C原子外围电子的轨道表示式为

分析:1mol A的单质与酸反应,能置换出1g H2,故A最外层有一个电子,失去一个电子形成A+,因A+具有与氖原子相同的电子层结构,所以A为Na元素.
因B的核电荷数比A大两个单位,所以B为Al元素,C的质子数比B多4个,所以C为Cl元素.按要求使用正确的化学用语.
因B的核电荷数比A大两个单位,所以B为Al元素,C的质子数比B多4个,所以C为Cl元素.按要求使用正确的化学用语.
解答:解:1mol A的单质与酸反应,能置换出1g H2,故A最外层有一个电子,失去一个电子形成A+,因A+具有与氖原子相同的电子层结构,所以A为Na元素.
因B的核电荷数比A大两个单位,所以B为Al元素,C的质子数比B多4个,所以C为Cl元素.
Na的原子结构示意图为: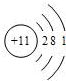 ,Al3+的核外电子排布式为:1s22s22p6,Cl原子外围电子的轨道表示式为:
,Al3+的核外电子排布式为:1s22s22p6,Cl原子外围电子的轨道表示式为: .
.
故答案为: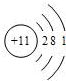 、1s22s22p6、
、1s22s22p6、 .
.
因B的核电荷数比A大两个单位,所以B为Al元素,C的质子数比B多4个,所以C为Cl元素.
Na的原子结构示意图为:
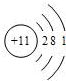 ,Al3+的核外电子排布式为:1s22s22p6,Cl原子外围电子的轨道表示式为:
,Al3+的核外电子排布式为:1s22s22p6,Cl原子外围电子的轨道表示式为: .
.故答案为:
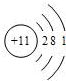 、1s22s22p6、
、1s22s22p6、 .
.点评:本题考察了元素的原子结构和性质.要注意题目的要求,是离子的电子排布式还是原子的电子排布式,还是价电子排布式,还是轨道表示式等,按要求使用化学用语.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)
如图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍.(用元素符号表示)