题目内容
某液化石油气由丙烷和丁烷组成,其质量分数分别为80%和20%,它们燃烧的热化学方程式分别为
C3H8(g)+5O2(g)→3CO2(g)+4H2O(g) △H=–2200KJ·mol-1
2C4H10(g)+13O2(g)→8CO2(g) +10H2O(g) △H=–5800KJ·mol-1
有一质量为0.8Kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗该液化石油气0.056Kg。试计算该燃料的利用率[已知水的比热为4.2KJ/(Kg·℃),铝的比热为0.88KJ/(Kg·℃)]
【答案】
50%
【解析】
试题分析:0.056Kg中丙烷和丁烷的质量分别是
56g×80%=44.8g、56g×20&=11.2g
物质的量分别是
44.8g÷44g/mol=1.0mol、11.2g÷56g/mol=0.2mol
所以完全燃烧放出的热量是
1.0mol×2220kJ/mol+0.1mol×5800kJ/mol=2800.0kJ
而烧水需要的能量是
4.2KJ/(Kg·℃)×4Kg×80℃+0.88KJ/(Kg·℃)×0.8Kg×80℃=1400.32kJ
因此该燃料的利用率是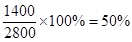
考点:考查燃烧效率的有关计算
点评:该题是基础性试题的考查,试题基础性强,有利于培养学生的规范答题能力,也有利于培养学生的能源节约意识,有利于调动学生的学习积极性。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
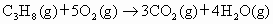 ;
;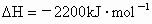
 ;
;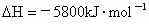
 ,铝的比热为
,铝的比热为 .
.