题目内容
某溶液中存在Na+、AlO2-、CO32-、OH-,向该溶液中滴加盐酸,问产生现象的顺序是什么,写出相关的离子方程式。
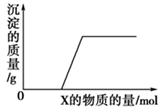
①一段时间保持原样 H++OH-=H2O,②开始产生沉淀并慢慢增多H++AlO2-+H2O=Al(OH)3↓ ,③沉淀量基本不变后产生一种气体CO32-+2H+=CO2↑+H2O,④最后沉淀慢慢溶解直至消失Al(OH)3+3H+=Al3++3H2O
【错解分析】在非氧化还原反应(也就是复分解反应)的离子反应中,由于无法通过上述的氧化性或还原性比较的方法来解释,所以相对比较复杂,我们可以用假设法来解决。
【正解】因为AlO2-、CO32-、OH-都要和H+反应,反应如下:
H++AlO2-+H2O=Al(OH)3↓ Al(OH)3+3H+=Al3++3H2O ①
CO32-+H+=HCO3- HCO3-+H+=CO2↑+H2O ②
H++OH-=H2O ③
假设H+先和AlO2-反应,那么生成的Al(OH)3又要与原溶液中OH-反应,而重新生成AlO2-,即为Al(OH)3+OH-=AlO2-+2H2O,所以假设不成立。
假设H+先和CO32-反应,那么生成的HCO3-又要和原溶液中的OH-反应,而重新生成CO32-,即为HCO3-+OH-=CO32-+H2O。所以应该先和OH-反应。
那么和OH-反应完之后,H+与哪个离子反应?仍然通过假设法。
假设H+先和 CO32-反应,那么就要生成HCO3-,而HCO3-会和AlO2-发生双水解,重新生成CO32-,即为HCO3-+AlO2-+H2O=Al(OH)3+CO32-,所以先和AlO2-反应,当AlO2-完全转化为Al(OH)3时,Al(OH)3和CO32-哪个先和H+反应。若先与Al(OH)3反应,那么生成的Al3+又要与CO32双水解反应,重新生成Al(OH)3,即为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑。所以先和CO32-反应,最后溶解Al(OH)3。
综上所述,反应现象依次为:①一段时间保持原样 H++OH-=H2O,②开始产生沉淀并慢慢增多H++AlO2-+H2O=Al(OH)3↓ ,③沉淀量基本不变后产生一种气体CO32-+2H+=CO2↑+H2O,④最后沉淀慢慢溶解直至消失Al(OH)3+3H+=Al3++3H2O

练习册系列答案
相关题目