题目内容
将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
| A.反应速率:两者相同 |
| B.消耗硝酸的物质的量:前者多,后者少 |
| C.反应生成气体的颜色:前者浅,后者深 |
| D.反应中转移的电子总数:前者多,后者少 |
B
试题分析:浓硝酸的氧化性强于稀硝酸,所以浓硝酸的反应速率大,A不正确;根据反应的化学方程式Cu+4HNO3=Cu(NO3)2+2H2O+2NO2↑、3Cu+8HNO3=3Cu(NO3)2+4H2O+2NO↑可知,在铜的质量相等的条件下,前者消耗的硝酸多,B正确;NO2是红棕色气体,NO是无色气体,C不正确;铜在反应中都是失去2个电子,转移电子的物质的量相等,D不正确,答案选B。
点评:该题是中等难度的试题,试题难易适中,贴近高考。在注重基础知识考查和巩固的同时,更注重学生能力的培养和训练,有利于培养学生的逻辑思维能力和发散思维能力,提高学生分析问题、解决问题的能力。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 4NO(g)+6H2O(g)在5 L密闭容器中进行,10s后H2O的物质的量增加了0.60 mol,则10s内反应的平均速率
4NO(g)+6H2O(g)在5 L密闭容器中进行,10s后H2O的物质的量增加了0.60 mol,则10s内反应的平均速率 (X)可表示为 ( )
(X)可表示为 ( )
 3C(g)+4D(g),
3C(g)+4D(g), 2C(g),下列各数据表示不同条件下的反应速率,
2C(g),下列各数据表示不同条件下的反应速率, 3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )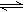 xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是
xM(g)+2N(g),5min后达到平衡生成1mol N,经测定这5min内 M的平均速率是0.1mol/(L·min),下列叙述错误的是