题目内容
(10分) 肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料。
![]() (1)32.0克该液态化合物在氧气中完全燃烧生成氮气放出热量624kJ(在101kPa,25℃ ),则肼完全燃烧的热化学方程式 。
(1)32.0克该液态化合物在氧气中完全燃烧生成氮气放出热量624kJ(在101kPa,25℃ ),则肼完全燃烧的热化学方程式 。
![]() (2)肼―空气燃料电池是一种碱性燃料电池,电解质溶液是20%―30%的KOH溶液。该电池放电时,正极的电极反应式是 。
(2)肼―空气燃料电池是一种碱性燃料电池,电解质溶液是20%―30%的KOH溶液。该电池放电时,正极的电极反应式是 。
![]() (3)右图是一个电化学装置示意图。用肼―空气燃料电池做此装置的电源。
(3)右图是一个电化学装置示意图。用肼―空气燃料电池做此装置的电源。
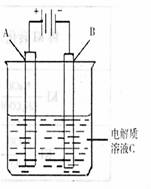
![]() ①如果A为含有锌、银、金等杂质的粗铜,
①如果A为含有锌、银、金等杂质的粗铜,![]() B为纯铜,C为CuSO4。通电一段时间后,A极质
B为纯铜,C为CuSO4。通电一段时间后,A极质
![]() 量的减少将 B极质量的增加(填“等于”
量的减少将 B极质量的增加(填“等于” ![]() 或“大于”或小于)。
或“大于”或小于)。
![]() ②如果A是铂电极,B是石墨电极,C是氯化钠溶液,
②如果A是铂电极,B是石墨电极,C是氯化钠溶液, ![]() 则若要制得11.2升Cl2气体(标况下),该燃料电池理
则若要制得11.2升Cl2气体(标况下),该燃料电池理 ![]() 论上需消耗 molN2H4。
论上需消耗 molN2H4。
![]() (4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是___________
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化效率高,其次是___________
(1)N2H4(l)+O2(g)=N2(g) +2H2O(l) △H=-624kJ/mol(2分)
(2)O2+2H2O+4 e― =4OH (2分)
(3)①大于(2分) ②0.25mol(2分)
(4)燃料电池减少了对空气的污染(2分)

练习册系列答案
相关题目
 肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水,用作火箭燃料.
 肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性液体,用作火箭燃料.
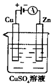 肼(N2H4)又称联氨,可用作火箭燃料.肼一空气燃料电池中的电解质溶液是20%~30%的KOH溶液.该燃料电池可作为如图装置中的电源.下列判断错误的是( )
肼(N2H4)又称联氨,可用作火箭燃料.肼一空气燃料电池中的电解质溶液是20%~30%的KOH溶液.该燃料电池可作为如图装置中的电源.下列判断错误的是( )