题目内容
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在 条件下进行,目的是为了避免 。
(2)Br2可用热空气吹出,其原因是 。
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。步骤②的产品有时运输到目的地后再酸化,主要是因为 .
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中 。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在 条件下进行,目的是为了避免 。
(2)Br2可用热空气吹出,其原因是 。
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。步骤②的产品有时运输到目的地后再酸化,主要是因为 .
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中 。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(1)酸性,Cl2歧化。
(2) Br2易挥发。
(3)3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O.溴酸能将Cl-氧化成Cl2,原因是Br2有强氧化性。
(4)ac。
Cl2与水发生歧化反应:Cl2+H2O=HCl+HClO,在酸性条件下可抑制该反应。步骤③所发生反应是归中反应,盐酸有还原性,NaBrO3有氧化性,二者可发生氧化还原反应;因为Br2有强氧化性,为了防止在运输过程中Br2与其它物质反应,因此步骤②的产品有时运输到目的地后再酸化。利用Br-与Cl2反应,可除去Cl2。
【考点定位】本题考查工业制Br2,考查分析问题解决问题的能力。
【考点定位】本题考查工业制Br2,考查分析问题解决问题的能力。

练习册系列答案
相关题目
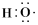
 、
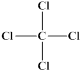
、
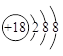 、1s22s22p63s23p6
、1s22s22p63s23p6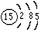
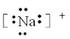
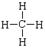
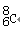


 ?
?