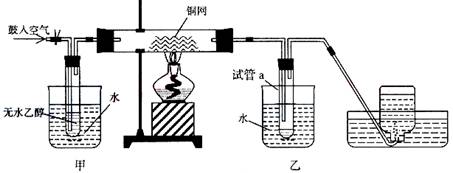
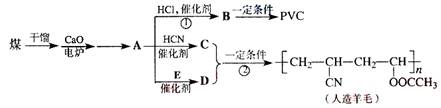
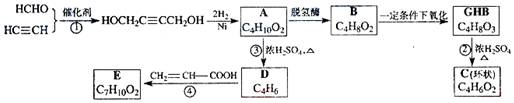
题目内容
(08年上海卷)下列物质中,只有氧化性、只有还原性,既有氧化性又有还原性的顺序排列的一组是 ( )
A.F2、K、HCl B.Cl2、Al、H2 C.NO2、Na、Br2 D.O2、SO2、H2O
答案:A
考点:元素的化合价与元素的氧化性还原性的关系
解析:元素具有最高价时只有氧化性,注意F2没有最高化合价,元素具有最低化合价时只有还原性,而处于中间价态时既具有氧化性又具有还原性。
相关知识点:
有关化合价在氧化还原反应中的应用
①、判断一个反应是否是氧化还原反应
有化合价变化的反应是氧化还原反应,该反应在一定条件下可能被设计成原电池。
②、利用元素的价态判断其氧化性和还原性
、最高价态的元素只有氧化性,常见阳离子的氧化性顺序:Ag+ >Fe3+ >Cu2+ >H+ 。
、最低价态的元素只有还原性,常见阴离子的还原性顺序:H- >S2- > I-。
、中间价态的元素既有氧化性,又有还原性,遇到强氧化剂时呈现还原性,遇到强还原剂时呈现氧化性。
例1:氢气与钠反应体现氧化性,氢气与氧气反应体现还原性,氢气更多的时候体现还原性,化学方程式:氧化性:2Na+H2 ![]() NaH2 ;还原性: H2 +CuO
NaH2 ;还原性: H2 +CuO ![]() H2O+Cu ;SiCl4 +2H2
H2O+Cu ;SiCl4 +2H2 ![]() Si+ 4HCl
Si+ 4HCl
例2:碳单质既体现氧化性,又可以体现还原性,更多时候体现还原性,化学方程式:
氧化性:C + Si ![]() SiC ;还原性:C +H2O
SiC ;还原性:C +H2O ![]() CO+H2 ;2C +SiO2
CO+H2 ;2C +SiO2 ![]() 2CO ↑+Si ;C+CO2
2CO ↑+Si ;C+CO2 ![]() 2CO ;
2CO ;
例3:二氧化硫既有氧化性又有还原性,更多时候体现还原性,化学方程式:
氧化性:2H2S +SO2 =3S+2H2O ;还原性:SO2 +Cl2 +2H2O=H2SO4 +2HCl ;2SO2 +O2 ![]() 2SO3
2SO3
例4:二氧化氮既有氧化性又有还原性,更多时候体现氧化性,化学方程式:
氧化性:(二氧化氮气体使润湿的淀粉碘化钾试纸变蓝)2KI +NO2=I2 +2KNO2
氧化性和还原性:3NO2 +2H2O=2HNO3 +NO
还原性:4NO2 +O2+2H2O=4HNO3
例5:亚硫酸钠既有氧化性又有还原性,通常以还原性为主,化学方程式:
氧化性:2Na2S+Na2SO3+3H2SO4=3Na2SO4+3S↓+3H2O
还原性:2Na2SO3+O2=2Na2SO4 ;Cl2+Na2SO3+H2O=Na2SO4+2HCl
③、同一元素价态越高氧化性越强,价态越低还原性越强。
例1:NaH+H2O=NaOH+H2 ↑
分析:氧化剂:H2O,氧化性:H2O> H2 ;还原剂:NaH,还原性:NaH> H2 。
例2:2FeCl3 +Fe=3FeCl2
分析:氧化剂:FeCl3,氧化性:FeCl3> FeCl2 ;还原剂:Fe,还原性:Fe > FeCl2 。
④、几种氧化剂分别与变价金属反应,使变价金属呈现较高价态的氧化剂的氧化性强。
例如:氯气和硫分别与铁反应,产物中铁的价态不同。2Fe+3Cl2 ![]() 2FeCl3 ,Fe+S
2FeCl3 ,Fe+S ![]() FeS ;氧化性:Cl2>S 。
FeS ;氧化性:Cl2>S 。
⑤、几种还原剂分别与氧气反应,生成物中氧元素的价态越高,该还原剂的还原性越强。
例如:2Na+O2 ![]() Na2O2 ,K+O2
Na2O2 ,K+O2 ![]() KO2 ,还原性:K>Na 。
KO2 ,还原性:K>Na 。
⑥、岐化反应种元素的价态变化规律:
在岐化反应只有一种元素发生化合价变化,反应物中变价元素的价态必然在生成物中变价元素的价态之间。
例如:在岐化反应(3S+6KOH=2K2S+K2SO3+3H2O)中,反应物中硫元素的价态介于生成物K2S和K2SO3的硫元素价态之间。
⑦、归中反应中元素的价态变化规律(化合价就近变化互不交叉原则):
在归中反应只有一种元素发生化合价变化,生成物中变价元素的价态必然在反应物中变价元素的价态之间。
例如:在归中反应(2K2S+K2SO3+3H2SO4=3S+3H2O+3K2SO4)中,生成物中(硫)元素的价态介于反应物K2S和K2SO3的硫元素价态之间。
例2:在归中反应(H2S+H2SO4(浓)=S↓+2H2O+SO2 ↑)中,生成物中(硫)元素的价态介于反应物H2S和H2SO4的硫元素价态之间:H2S→S;H2SO4(浓)→SO2。
⑧、利用化合价变化规律推测产物:
化合价变化规律:在一个化学反应中,有化合价升高的元素,必有化合价降低的元素,化合价升高的总数等于化合价降低的总数。
例如:推测钠与水的产物:在钠与水的反应中,滴入无色酚酞,溶液变红,说明钠与水反应生成物有碱(氢氧化钠)生成。反应物只有单质钠和水,钠元素化合价升高,水中必有一种元素化合价降低,而氧元素已经呈最低价态,只能是+1价的氢元素化合价降低,得电子变成氢气,所以钠与水反应的产物是氢氧化钠和氢气。