题目内容
某化学反应
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为__________mol·(L·min)-1。
(2)在实验2,A的初始浓度c2=_________mol·L-1,反应经20分钟就达到平衡,可推测实验2中还隐含的反应条件是_________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_________v1(填“>”“=”或“<”)且c3_________1.0 mol·L-1(填“>”“=”或“<”)
(4)比较实验4和实验1,可推测反应速率快的是________,理由是________________________
_____________________________________________________________________。
解析:本题综合考查了浓度、温度、催化剂对化学反应速率的影响。此题综合性较强,要综合考虑浓度、温度、催化剂对化学反应速率的影响,从而对影响反应速率的时间变化表格,提出合理的解释并定量计算。不同的实验条件或同一次实验的不同时刻,浓度的变化是不同的,故在Δt时间内的浓度变化应视为这段时间内的平均速率。实验1,在反应后10至20分钟内的平均速率应为v(A)=![]() =0.013 mol·(L·min)-1。
=0.013 mol·(L·min)-1。
实验2,在相同反应温度下,达到平衡时A的浓度不变,但达到平衡的时间缩短了,故推测A的初始浓度并没有变,即c2=1 mol·L-1,但反应中使用了催化剂。实验3,在相同反应温度下,达到平衡时A的浓度变大了,且在相同的时间间隔10至20分钟内,A的浓度变化量增至0.92 mol-0.75 mol=0.17 mol,故可推测v3>v1,且c3>1.0 mol·L-1。实验4,温度高,速率快。
答案:(1)0.013 (2)1.0 催化 (3)> >
(4)实验4 温度越高,反应速率越快

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案 B+D在四种不同条件下进行,B、D起始浓度为零.反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为零.反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: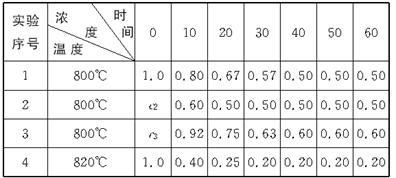
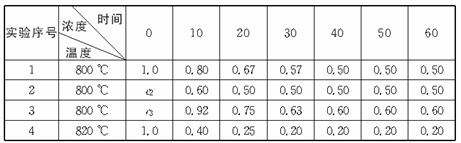
 B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。
B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。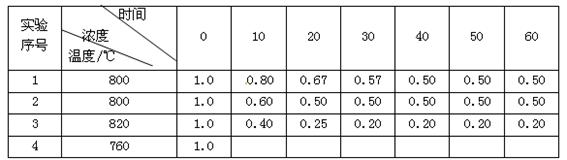
 www.k@s@5
www.k@s@5 @u.com
@u.com