题目内容
(10分)处于相邻两个周期的主族元素A、B、C、D,它们的原子半径依次变小;A离子和B离子的电子层相差两层,且能形成BA2型的离子化合物;C的离子带3个正电荷且核外电子排布与氖相同;D气态氢化物的分子式为H2D,D在它的最高价氧化物中的质量分数是40%且D原子核中有16个中子。试回答:
(1)按要求填空:
A元素的名称 B元素的符号
C原子的外围电子排布式为 D的原子结构示意图
(2)B、C、D的第一电离能由大到小的顺序是: (填元素符号)
(3)A、B、C的电负性由大到小的顺序是: (填元素符号)
(4)A与B形成的化合物的电子式
(5)将C投入到的KOH溶液中现象为 ,相应的离子反应方程式为 。(2分)
(1)A 溴 B Mg C 3S23P1 D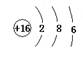
(2)B、C、D的第一电离能由大到小的顺序是: S > Mg > Al 。
(3)A、B、C的电负性由大到小的顺序是: Br > Al > Mg 。
(4)
![]()
(5)金属溶解,产生大量气体;2Al+2H2O+2OH-=2AlO2-+3H2á(2分)

练习册系列答案
相关题目
根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
(1)在周期表中,最可能处于同一族的是
A.Q和R B.E和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是
A.E2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是 区元素,其氯化物的化学式为
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明了原子核外 .
(6)如果R、E、T是同周期的三种主族元素,其中元素 的第一电离能反常高的原因是 .
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| E | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
A.Q和R B.E和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是
A.E2+ B.R+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明了原子核外
(6)如果R、E、T是同周期的三种主族元素,其中元素
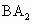 型离子化合物.C的离子带3个正电荷.D的气态氢化物通式为
型离子化合物.C的离子带3个正电荷.D的气态氢化物通式为 ,在最高价氧化物中,D含量为40%,D的原子序数大致等于其相对原子质量数值的一半.试回答(写名称、符号):
,在最高价氧化物中,D含量为40%,D的原子序数大致等于其相对原子质量数值的一半.试回答(写名称、符号):