题目内容
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+。下列叙述不正确的是
| A.氧化产物为Cl2 |
| B.氧化剂与还原剂的物质的量之比为1∶2 |
| C.若有3mol H2O生成,则反应中有2mol电子转移 |
| D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移 |
D
解析试题分析:在氧化还原反应中,氧化剂+还原剂→还原产物+氧化产物。由于在常温下可用Co2O3制备Cl2,说明Co2O3是氧化剂,Cl2是氧化产物,根据上述规律,结合电子守恒的知识可得方程式是Co2O3+ 6H+ + 2Cl-=Cl2+3H2O +2Co2+.氧化剂与还原剂的物质的量的比为1:2,在反应方程式中每产生1mol的Cl2,电子转移2mol,同时生成3mol H2O。但是若产生标准状况下0.1mol的Cl2时,其体积为2.24L Cl2,反应中有0.1mol电子转移。若气体的体积为指明条件是无意义的。因此选项为D。
考点:考查氧化还原反应的规律的知识。

将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
| A.与NaOH反应的氯气一定为0.15 mol |
| B.n(Na+)∶n(Cl-) 可能为7∶3 |
| C.若反应中转移的电子为n mol,则n一定大于0.15 mol |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为7∶2∶1 |
铋(Bi)是第VA族元素,+5价Bi的化合物氧化性大于MnO4—。某反应中反应物与生成物有:NaMnO4、NaBiO3、Na2SO4、MnSO4、Bi2(SO4)3、H2O和一种未知物X。下列关于该反应的描述中不正确的是
| A.X是H2SO4 |
| B.反应中Mn原子与Bi原子个数比为5:2 |
| C.该反应中NaBiO3作氧化剂 |
| D.该反应中Na2SO4既不是氧化产物,又不是还原产物 |
给汽车安装尾气净化装置,汽车尾气通过净化装置(内有钯等过渡金属元素做催化剂)后,其中的有害气体CO、NO转化为无害气体N2、CO2则( )
| | A. | NO作为还原剂 | B. | CO作为还原剂 | C. | N2作为还原剂 | D. | CO2作为氧化剂 |
根据表中信息判断,下列选项正确的是( )
| A.第①组反应的其余产物为H2O |
| B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2 |
| C.第③组反应中生成1mol Cl2,转移电子5mol |
| D.氧化性由强到弱顺序为MnO4 >Cl2> Fe3+> Br2 |
根据表中信息,判断下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | | FeBr2 | / | | Cl- |
| ② | MnO2 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:MnO2>Fe3+>Cl2>Br2
C.表中②组反应的氧化产物是MnCl2,1molMnO2电子转移数目是2NA
D.表中③组反应的离子方程式为:2MnO4—+3H2O2+6H+=2Mn2++4O2↑+6H2O
在2009年10月1日,新的饮用矿泉水强制性国家标准《饮用天然矿泉水》正式实施,其中“溴酸盐(BrO3-)”这一潜在致癌物质被做了严格限制。有关专家解释,矿泉水在开采过程中会含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是( )
| A.该过程中溴化物(Br-)得到电子 |
| B.该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂 |
| C.该过程中溴元素被还原,氧元素被氧化 |
| D.该过程中溴元素发生氧化反应,氧元素发生还原反应 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是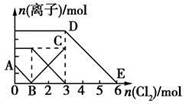
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3 mol |
| C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1:2 |
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是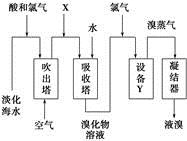
| A.X为SO2气体,也可将SO2换成Na2SO3 |
| B.设备Y为蒸馏塔 |
| C.在提取溴的过程中一定有Br-被氧化 |
| D.工业上每获得1 mol Br2,需要消耗Cl2的体积最多为44.8 L(标准状况下) |