题目内容
在一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
| A.1.0体积的N2和3.0体积的H2 |
| B.2.0体积的N2、6.0体积的H2和4.0体积的NH3 |
| C.2.0体积的NH3 |
| D.4.0体积的NH3和1.0体积的H2 |
D
解析答案:D
A.1.0体积的N2和3.0体积的H2,相当于将题干中的平衡达到平衡后截取一半
B.2.0体积的N2、6.0体积的H2和4.0体积的NH3,将4.0体积的NH3看成是2.0体积的N2、6.0体积的H2,即用4.0体积的N2、12.0体积的H2建立平衡,相当于将题干中的平衡达到平衡后放大到原来的两倍
C.2.0体积的NH3,转化为1.0体积的N2和3.0体积的H2,相当于将题干中的平衡达到平衡后截取一半
D.4.0体积的NH3和1.0体积的H2,转化为反应物2.0体积的N2和7.0体积的H2,与原平衡不成倍比关系,不符合恒压等效平衡的特点。故D中保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1

练习册系列答案
相关题目
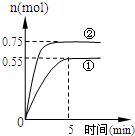 碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如下图所示:
碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如下图所示: