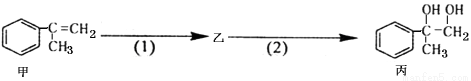题目内容
已知H2A是一种无机二元酸,请回答以下问题:
(1) 若H2A为二元弱酸,在水溶液中的电离方程式为 ;
(2) 若NaHA溶液显碱性,则H2A是 (填“强酸”、“弱酸”或“无法确定”),原因是 。
(3) 若溶液显酸性,在25℃下,若向0.1 mol·L-1的NaHA溶液中逐滴滴加0.1 mol·L-1 KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 ;
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=0.1 mol·L-1
c.c(Na+)>c(K+) d.c(Na+)=c(HA-)+c(A2-)
(1)H2A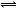 H++HA-,HA-
H++HA-,HA- 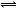 H++A2- (2分)
H++A2- (2分)
(2)弱酸(1分) HA-水解生成H2A和OH-使溶液显碱性,故H2A必为弱酸;(2分)
(3)a(2分) ;
【解析】
试题分析:(1)多元弱酸部分电离,分步书写。(2)若NaHA溶液显碱性, 说明HA-水解生成H2A和OH-使溶液显碱性,故H2A必为弱酸;(3)在25℃下,任何溶液一定存在c(H+)·c(OH-)=1×10-14,故a正确;滴加到溶液刚好反应时,生成Na2A和K2A,溶液呈碱性,要成中性必须NaHA过量,故b错、C错;根据物料守恒:c(Na+)=c(HA-)+c(A2-)+ c(H2A),故d错。
考点:考查弱电解质的电离、盐类水解、水溶液中的离子平衡等相关知识。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目