题目内容
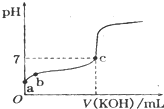 已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题.
已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题.(1)a点溶液中c(H+)为
4×10-4mol/L
4×10-4mol/L
mol?L-1;(2)b点溶液中离子浓度大小顺序为
c(CH3COO-)>c(K+)>c(H+)>c(OH-)
c(CH3COO-)>c(K+)>c(H+)>c(OH-)
或c(CH3COO-)>c(H+)>c(K+)>c(OH-)
c(CH3COO-)>c(H+)>c(K+)>c(OH-)
.C点溶液中离子浓度大小顺序为
c(CH3COO-)=c(K+)>c(H+)=c(OH-)
c(CH3COO-)=c(K+)>c(H+)=c(OH-)
.(3)a、b、c三点中水的电离程度最大的是
c
c
.分析:(1)c(H+)=
;
(2)b点溶液呈酸性,溶液中的溶质是醋酸钾和醋酸,c点混合溶液呈中性,氢离子浓度等于氢氧根离子浓度,根据物料守恒及电荷守恒分析解答;
(3)酸或碱抑制水电离,根据溶液的酸碱性确定水的电离程度大小.
| K.C(CH3COOH) |
(2)b点溶液呈酸性,溶液中的溶质是醋酸钾和醋酸,c点混合溶液呈中性,氢离子浓度等于氢氧根离子浓度,根据物料守恒及电荷守恒分析解答;
(3)酸或碱抑制水电离,根据溶液的酸碱性确定水的电离程度大小.
解答:解:(1)c(H+)=
=
mol/L=4×10-4mol/L,
故答案为:4×10-4;
(2)b点溶液呈酸性,溶液中的溶质是醋酸钾和醋酸,当醋酸钾的物质的量大于或醋酸的物质的量,则溶液中离子浓度大小顺序是c(CH3COO-)>c(K+)>c(H+)>c(OH-),当醋酸钾的物质的量远远小于醋酸的物质的量时,溶液中离子浓度大小顺序是c(CH3COO-)>c(H+)>c(K+)>c(OH-);
c点混合溶液呈中性,氢离子浓度等于氢氧根离子浓度,根据电荷守恒得c(CH3COO-)=c(K+)>c(H+)=c(OH-);
故答案为:c(CH3COO-)>c(K+)>c(H+)>c(OH-)或c(CH3COO-)>c(H+)>c(K+)>c(OH-);
c(CH3COO-)=c(K+)>c(H+)=c(OH-);
(3)酸或碱抑制水电离,a和b点溶液都呈酸性,所以抑制水电离,c点呈中性,则水的电离程度最大,故选c.
| K.C(CH3COOH) |
| 1.6×10-5×0.01 |
故答案为:4×10-4;
(2)b点溶液呈酸性,溶液中的溶质是醋酸钾和醋酸,当醋酸钾的物质的量大于或醋酸的物质的量,则溶液中离子浓度大小顺序是c(CH3COO-)>c(K+)>c(H+)>c(OH-),当醋酸钾的物质的量远远小于醋酸的物质的量时,溶液中离子浓度大小顺序是c(CH3COO-)>c(H+)>c(K+)>c(OH-);
c点混合溶液呈中性,氢离子浓度等于氢氧根离子浓度,根据电荷守恒得c(CH3COO-)=c(K+)>c(H+)=c(OH-);
故答案为:c(CH3COO-)>c(K+)>c(H+)>c(OH-)或c(CH3COO-)>c(H+)>c(K+)>c(OH-);
c(CH3COO-)=c(K+)>c(H+)=c(OH-);
(3)酸或碱抑制水电离,a和b点溶液都呈酸性,所以抑制水电离,c点呈中性,则水的电离程度最大,故选c.
点评:本题利用中和滴定图象,考查了电离平衡常数的利用、离子浓度大小比较及水的电离程度比较,难度适中,可能判断b点浓度大小稍有难度.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目