题目内容
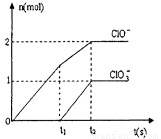
 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.(1)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为
10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O
10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O
.(2)该石灰乳中含有Ca(OH)2的物质的量是
5
5
mol.(3)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O-和C1O3-的比例也不同.若在原石灰乳中通入氯气的速度加快,则反应后
| n(ClO-) | n(ClO3-) |
<
<
2(填“>”、“<”或“=”).分析:(1)根据氧化还原反应中得失电子数相等结合图象写出反应方程式.
(2)根据离子方程式中次氯酸根离子和氢氧化钙物质的量之间的关系式计算.
(3)通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n(C1O3-)增多.
(2)根据离子方程式中次氯酸根离子和氢氧化钙物质的量之间的关系式计算.
(3)通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n(C1O3-)增多.
解答:解:(1)由图可知,t2时n(C1O-)=2mol,n(C1O3-)=1mol,氯气与氢氧化钙反应生成CaCl2、Ca(ClO)2、Ca(ClO3)2、H2O,且n[Ca(ClO)2]:n[Ca(ClO3)2]=2:1,反应方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
故答案为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
(3)由图可知,t2时氢氧化钙与氯气恰好反应,n(C1O-)=2mol,故n[Ca(ClO)2]=1mol,n(C1O3-)=1mol,故n[Ca(ClO3)2]=0.5mol,根据方程式10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O可知,n[Ca(OH)2]=10n[Ca(ClO3)2]=0.5mol×10=5mol.
故答案为:5.
(4)①t2时n(C1O-)=2mol,n(C1O3-)=1mol,n(C1O-):n(C1O3-)=2,通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n(C1O3-)增多,所以n(C1O-):n(C1O3-)<2.
故答案为:<.
故答案为:10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O.
(3)由图可知,t2时氢氧化钙与氯气恰好反应,n(C1O-)=2mol,故n[Ca(ClO)2]=1mol,n(C1O3-)=1mol,故n[Ca(ClO3)2]=0.5mol,根据方程式10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O可知,n[Ca(OH)2]=10n[Ca(ClO3)2]=0.5mol×10=5mol.
故答案为:5.
(4)①t2时n(C1O-)=2mol,n(C1O3-)=1mol,n(C1O-):n(C1O3-)=2,通入氯气的速率加快,反应速率加快,反应放出的热量无法很快散失,体系温度升高,生成的n(C1O3-)增多,所以n(C1O-):n(C1O3-)<2.
故答案为:<.
点评:本题考查了氯气的性质、根据图象进行物质的量的有关计算等知识点,难度较大,明确氧化还原反应中得失电子数相等是解本题的关键.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
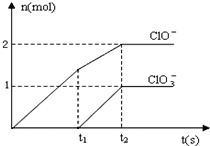
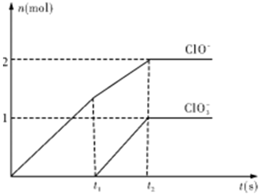 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、 (2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、
(2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、