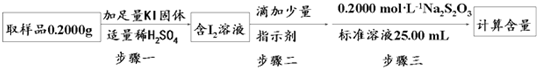
题目内容
漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为:5HClO2=4ClO2↑+H++Cl-+2H2O。向NaClO2溶液中滴加H2SO4,开始反应缓慢,随后反应迅速,其原因是
[ ]
A. 在酸性条件下亚氯酸的氧化性增强
B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物降低
D. 溶液中的Cl-起催化作用
B. 溶液中的H+起催化作用
C. ClO2逸出,使反应的生成物降低
D. 溶液中的Cl-起催化作用
D

练习册系列答案
相关题目
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2,HClO2,ClO2-,Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。某温度下,各组分含量随pH变化情况如图所示(Cl-没有画出)。
下列说法正确的是 ( )
| A.NaClO2溶液中,c(Na+)/c(ClO2-)=1 |
| B.往NaClO2溶液中滴入稀盐酸,当pH>6时,溶液中主要反应的离子方程式是:ClO2-+H+=HClO2 |
| C.使用该漂白剂的最佳pH为3.0 |
| D.此温度下HClO2的电离平衡常数的数值Ka=10-6 |