题目内容
 下列有关实验原理或操作正确的是
下列有关实验原理或操作正确的是
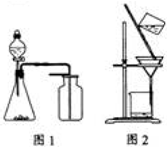
- A.选择合适的试剂,用图1所示装置可分别制取收集少量CO2、NO、O2
- B.配制FeSO4溶液时,一般加一定量稀硫酸和足量铁粉,并且现配现用
- C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
- D.用干燥的pH试纸可测得新制氯水的pH=2
B
分析:A、和氧气不反应的气体可以采用排空气法收集.
B、氯化亚铁易被氧化,易水解,所以配制FeSO4溶液时,一般加一定量稀硫酸和足量铁粉,并且现配现用.
C、洗涤沉淀时用玻璃棒引流,注入蒸馏水,直至没过沉淀,然后等待液体从漏斗底部流走,重复步骤两到三次.
D、氯水具有漂白性,可使试纸褪色.
解答:A、实验室制取二氧化碳可用大理石与稀盐酸在常温下反应,由于二氧化碳密度比空气大,可用向上排空气法收集,可选择图1装置;双氧水在二氧化锰催化作用下制取氧气,选用固液不加热装置,氧气密度比空气大,用向上排空气法收集,可选择图1装置;一氧化氮可以和氧气反应,不能用向上排空气法收集,故A错误.
B、硫酸亚铁溶液中亚铁离子易被空气氧化生成铁离子,且硫酸亚铁易水解,所以为防止被氧化和水解,所以配制FeSO4溶液时,一般加一定量稀硫酸和足量铁粉,并且现配现用,故B正确.
C、洗涤沉淀时用玻璃棒引流,注入蒸馏水,直至没过沉淀,然后等待液体从漏斗底部流走,重复步骤两到三次,不能用玻璃棒搅拌,故C错误.
D、氯水中含有HClO,具有漂白性,可使试纸褪色,不能测得PH,应用PH计,故D错误.
故选B.
点评:本题气体发生装置和收集装置的选择和基本实验操作,要会根据制取气体的反应原理和气体的性质来选择合适的装置.
分析:A、和氧气不反应的气体可以采用排空气法收集.
B、氯化亚铁易被氧化,易水解,所以配制FeSO4溶液时,一般加一定量稀硫酸和足量铁粉,并且现配现用.
C、洗涤沉淀时用玻璃棒引流,注入蒸馏水,直至没过沉淀,然后等待液体从漏斗底部流走,重复步骤两到三次.
D、氯水具有漂白性,可使试纸褪色.
解答:A、实验室制取二氧化碳可用大理石与稀盐酸在常温下反应,由于二氧化碳密度比空气大,可用向上排空气法收集,可选择图1装置;双氧水在二氧化锰催化作用下制取氧气,选用固液不加热装置,氧气密度比空气大,用向上排空气法收集,可选择图1装置;一氧化氮可以和氧气反应,不能用向上排空气法收集,故A错误.
B、硫酸亚铁溶液中亚铁离子易被空气氧化生成铁离子,且硫酸亚铁易水解,所以为防止被氧化和水解,所以配制FeSO4溶液时,一般加一定量稀硫酸和足量铁粉,并且现配现用,故B正确.
C、洗涤沉淀时用玻璃棒引流,注入蒸馏水,直至没过沉淀,然后等待液体从漏斗底部流走,重复步骤两到三次,不能用玻璃棒搅拌,故C错误.
D、氯水中含有HClO,具有漂白性,可使试纸褪色,不能测得PH,应用PH计,故D错误.
故选B.
点评:本题气体发生装置和收集装置的选择和基本实验操作,要会根据制取气体的反应原理和气体的性质来选择合适的装置.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
