题目内容
(15分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol·L-1NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。
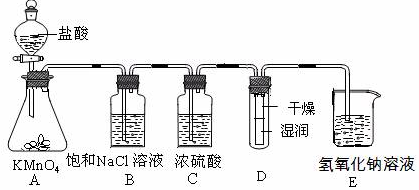
(1)配制物质的量浓度为0.375 mol·L-1NaOH溶液100mL时, 用托盘天平称取所需的NaOH质量为 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应方程式为 。
(4)装置B中饱和NaCl溶液的作用是 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因
;如需改进,请简述设计方案 (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂白水溶液355g,其中含NaClO的物质的量为 mol。

(1)配制物质的量浓度为0.375 mol·L-1NaOH溶液100mL时, 用托盘天平称取所需的NaOH质量为 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应方程式为 。
(4)装置B中饱和NaCl溶液的作用是 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因
;如需改进,请简述设计方案 (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂白水溶液355g,其中含NaClO的物质的量为 mol。
( 1) 1.5 g (2分)
(2)干燥氯气(2分)
(3)Cl2 + 2NaOH =" NaCl" + NaClO + H2O(3分)
(4)除去Cl2中的HCl气体(2分)
(5)不合理;实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色。(2分)
取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中。或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中。(2分,合理给分)
(6)0.5(2分)
(2)干燥氯气(2分)
(3)Cl2 + 2NaOH =" NaCl" + NaClO + H2O(3分)
(4)除去Cl2中的HCl气体(2分)
(5)不合理;实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色。(2分)
取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中。或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中。(2分,合理给分)
(6)0.5(2分)
略

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目


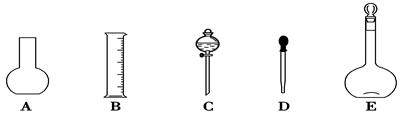
 次,洗涤液也转移至容量瓶
次,洗涤液也转移至容量瓶 托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1 (填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将N
托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1 (填“大于”“等于”或“小于”,下同);若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________0.1 mol·L-1;溶解NaOH后在未降至室温时,立即将N aOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。
aOH溶液转移至容量瓶定容,则所得溶液浓度_______ 0.1 mol·L-1。