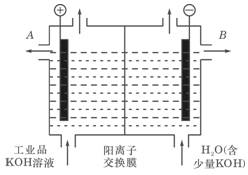
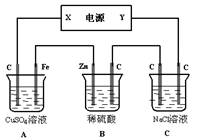
题目内容
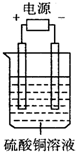 如图电解池中装有硫酸铜溶液,选用不同的、材料的电极进行电解.下列说法正确的是( ) 如图电解池中装有硫酸铜溶液,选用不同的、材料的电极进行电解.下列说法正确的是( )
| ||||||||||||||||||||||
分析:A.用石墨作电极电解CuSO4溶液,电解反应为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,阴极质量增加;生成H2SO4,pH减小;
B.用铜作电极电解CuSO4溶液,阳极:Cu-2e-=Cu2+,阴极:Cu2++2e-═Cu;
C.用铁作阳极作电极电解CuSO4溶液,阳极:Fe-2e-=Fe2+,质量减小,阴极Cu2++2e-═Cu质量增加;
D.用铁作阳极作电极电解CuSO4溶液,阳极:Fe-2e-=Fe2+,质量减小,阴极Cu2++2e-═Cu质量增加,反应本质为Fe+Cu2+═Fe2++Cu,溶液中离子发生变化,水解情况改变,pH变化;
| ||
B.用铜作电极电解CuSO4溶液,阳极:Cu-2e-=Cu2+,阴极:Cu2++2e-═Cu;
C.用铁作阳极作电极电解CuSO4溶液,阳极:Fe-2e-=Fe2+,质量减小,阴极Cu2++2e-═Cu质量增加;
D.用铁作阳极作电极电解CuSO4溶液,阳极:Fe-2e-=Fe2+,质量减小,阴极Cu2++2e-═Cu质量增加,反应本质为Fe+Cu2+═Fe2++Cu,溶液中离子发生变化,水解情况改变,pH变化;
解答:解:A.用石墨作电极电解CuSO4溶液,电解过程中,阳极:溶液中阴离子OH-、SO42-移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑;阴极:溶液中阳离子Cu2+、H+移向阴极发生还原反应,电极反应:2Cu2++4e-═2Cu;所以溶液中阴极质量增加;氢氧离子浓度逐渐减小,氢离子浓度逐渐增大,pH值逐渐变小,故A错误;
B.用铜作电极电解CuSO4溶液,阳极金属铜优先溶液中的阴离子放电,Cu-2e-=Cu2+,阴极:溶液中阳离子Cu2+、H+移向阴极发生还原反应,电极反应:Cu2++2e-═Cu;所以溶液中阳极质量减少,阴极质量增加,故B正确;
C.用铁作阳极作电极电解CuSO4溶液,阳极金属铁优先溶液中的阴离子放电,阳极:Fe-2e-=Fe2+,质量减小,阴极溶液中阳离子放电顺序为:Ag+>Fe3+>Cu2+>H+>Fe2+>Na+,所以阴极反应为Cu2++2e-═Cu质量增加,故C错误;
D.用铁作阳极作电极电解CuSO4溶液,阳极:Fe-2e-=Fe2+,质量减小,阴极Cu2++2e-═Cu质量增加,反应本质为Fe+Cu2+═Fe2++Cu,溶液中原来是Cu2+水解,反应后离子发生变化变为Fe2+,Fe2+水解能力不及Cu2+,两种离子水解情况不同,所以溶液的pH变化,故D错误;
故选B.
B.用铜作电极电解CuSO4溶液,阳极金属铜优先溶液中的阴离子放电,Cu-2e-=Cu2+,阴极:溶液中阳离子Cu2+、H+移向阴极发生还原反应,电极反应:Cu2++2e-═Cu;所以溶液中阳极质量减少,阴极质量增加,故B正确;
C.用铁作阳极作电极电解CuSO4溶液,阳极金属铁优先溶液中的阴离子放电,阳极:Fe-2e-=Fe2+,质量减小,阴极溶液中阳离子放电顺序为:Ag+>Fe3+>Cu2+>H+>Fe2+>Na+,所以阴极反应为Cu2++2e-═Cu质量增加,故C错误;
D.用铁作阳极作电极电解CuSO4溶液,阳极:Fe-2e-=Fe2+,质量减小,阴极Cu2++2e-═Cu质量增加,反应本质为Fe+Cu2+═Fe2++Cu,溶液中原来是Cu2+水解,反应后离子发生变化变为Fe2+,Fe2+水解能力不及Cu2+,两种离子水解情况不同,所以溶液的pH变化,故D错误;
故选B.
点评:本题以电解硫酸铜为载体考查了电解原理,明确不同电极材料的电极反应是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
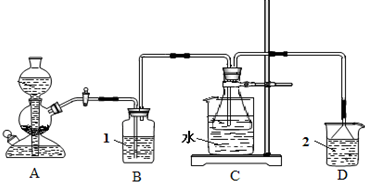
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题: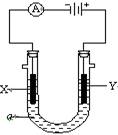 流电源相连。请回答以下问题:
流电源相连。请回答以下问题: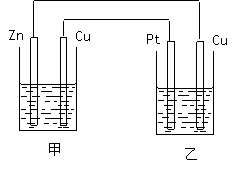 ①在这两个装置中,甲装置是 (原电池或电解池),甲中铜电极上的电极反应为
①在这两个装置中,甲装置是 (原电池或电解池),甲中铜电极上的电极反应为