题目内容
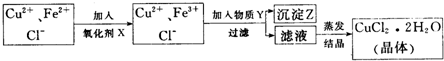
氯化铜晶体中常含FeCl2杂质,为制得纯净氯化铜晶体(CuCl2·2H2O),首先将其溶于稀盐酸中,然后按下面所示操作步骤进行提纯。
已知:
| 氢氧化物开始沉淀时的pH | 氯氧化物沉淀完全时的pH |
Fe3+ | 1.9 | 3.2 |
Cu2+ | 4.7 | 6.7 |
(1)下列物质中,最适合作为氧化剂X的是_____________________(填序号)
A.H2O2 B.KMnO
写出加入X后发生反应离子的方程式_____________________。
(2)加入的物质Y可以是,目的是________________________________________。
(3)某同学利用反应Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
设计实验来制取氯化铜溶液。该同学设计的装置应该为________________。(填“原电池”或“电解池”)。请在下侧方框中画出该同学设计的装置图,并指明电极材料和电解质溶液。
|
(4)从CuCl2稀溶液中得到CuCl2·2H2O晶体,在蒸发结晶的过程中,为了防止Cu2+的水解,应采取的措施是________________________________。
(1)A 2Fe2++H2O2+2H+![]() 2Fe3++2H2O
2Fe3++2H2O
(2)CuO或Cu(OH)2或CuCO3 调节溶液的pH,只生成Fe(OH)3沉淀;
(3)电解池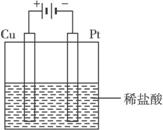
(4)加入适量稀盐酸
解析:(1)H2O2作氧化剂,不引入杂质,故选A。
2Fe2++H2O2+2H+![]() 2Fe3++2H2O
2Fe3++2H2O
(2)不引入杂质,并且提高pH,应加入CuO或Cu(OH)2或CuCO3;
目的是调节溶液的pH,只生成Fe(OH)3沉淀。
(3)此反应为非自发反应,应在电解条件下进行,为电解池。
(4)为了防止Cu2+的水解应加入适量稀盐酸。

练习册系列答案
相关题目