题目内容
(10分)食醋分为酿造醋和配制醋两种。国家标准规定酿造食醋总酸含量不得低于3.5g/100mL。
(1)某研究小组利用滴定分析法测定某品牌食醋中醋酸的含量,下列说法正确的是 。
a.用NaOH溶液滴定时反应的离子方程式为:H++OH-=H2O
b.食醋试样需稀释一定倍数后再进行滴定
c.用NaOH溶液滴定食醋,可使用酚酞或甲基橙作指示剂
d.若测得该品牌食醋的物质的量浓度为0.75mol·L-1,则该食醋的总酸量为4.5g/100mL。
(2)研究小组的同学仔细观察了该品牌食醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与食品添加剂(苯甲酸钠C6H5COONa)不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的 (填写序号)。
a.pH b.电离度 c.电离常数 d.溶解度
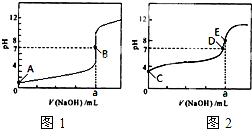
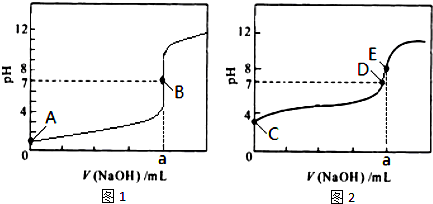
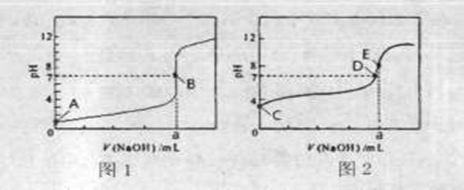
(3)常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00mL 0.1000 mol·L-1HCl溶液和20.00mL 0.1000 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示。
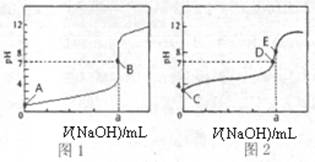
①滴定醋酸溶液的曲线是 (填“图l”或“图2”);滴定曲线中a= mL;
②E点pH>8的原因用离子方程式表示 。
(4)现欲粗略测定一未知浓度的CH3COOH溶液的电离度,应做的实验和所需的试剂(试纸)是 。
a.电解,NaOH溶液 b.蒸馏,Na2CO3溶液
c.酯化反应,石蕊试液 d.中和滴定,pH试纸
(1)bd (2)c (3)①图2 20.00mL
② Ac-+H2O 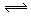 HAc+OH-
(4)
d
HAc+OH-
(4)
d
【解析】(1)醋酸是弱酸,离子方程式中用化学式表示,a不正确。浓度过大,反应过快,不利于判断滴定终点,所以可以通过稀释来降低反应速率,b正确。醋酸和氢氧化钠反应,终点时溶液显碱性,因此选择酚酞作指示剂,不用甲基橙。物质的量浓度为0.75mol·L-1,则该食醋的总酸量为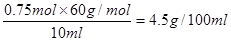 ,d正确。
,d正确。
(2)根据较强酸制取较弱的原理可判断,可通过比较二者的电离常数来比较其酸性强弱。
(3)盐酸和氢氧化钠恰好反应时溶液显中性,而醋酸和氢氧化钠恰好反应时溶液显碱性,所以图2表示醋酸的滴定曲线。醋酸钠水解显碱性,方程式为Ac-+H2O
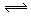 HAc+OH-。
HAc+OH-。
(4)电离度是指在一定温度下,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数。因此要测定醋酸的电离度,需要测定醋酸的物质的量浓度以及已电离的醋酸的物质的量浓度。根据电离方程式可知,可通过测定溶液的pH值来测定已电离的醋酸的物质的量浓度。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案