题目内容
(14分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20 ℃/g)如下表,请依据表中数据解释下列问题:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3- 、NH4+ 、Ca2+、Mg2+,流程示意如下:
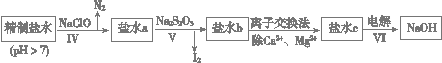
① 过程Ⅳ除去的离子有______、_______。
② 盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③ 过程VI中,产品NaOH在电解槽的__________区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
(1)SO42-
(2)①BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全
②在BaCO3、CaCO3、Mg2(OH)2CO3中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全
(3)① NH4+ 、I-
② 5S2O32-+8IO3- +2OH- = 4I2+10SO42-+H2O
③阴极,阳
解析试题分析:⑴加入过量BaCl2溶液能除去粗盐水中的SO42-;
⑵①由于BaSO4的溶解度比CaSO4的小,用CaCl2不能将SO42-沉淀完全,故选用BaCl2才能将其除尽;
②在BaCO3、CaCO3、Mg2(OH)2CO3等沉淀中,BaCO3的溶解度相对最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全;
⑶①NaClO有强氧化性能将NH4+ 、I-等分别氧化为N2、IO3- 除去
②据题意首先根据得失电子守恒有5S2O32-+8IO3- +2OH-―― 4I2+10SO42-+H2O,再根据电荷守恒有5S2O32-+8IO3- +2OH-――4I2+10SO42-+H2O,最后根据原子守恒得5S2O32-+8IO3- +2OH- = 4I2+10SO42-+H2O。
③电解饱和食盐水在阴极区得NaOH和H2,在阳极区得Cl2,用阳离子交换膜(只允许阳离子通过、阴离子和气体不能通过)能阻止Cl2与NaOH、H2混合反应。
考点:本题考查粗盐的提纯、氧化还原反应类型的离子方程式书写、氯碱工业等。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案在熔融KOH中大气中的氧可将铬铁矿FeCr2O4中Fe和Cr的化合价都转化为+6价,氧化 1 mol FeCr2O4在理论上需要多少摩尔氧气
| A.2mol | B.2.5mol | C.3mol | D.4mol |

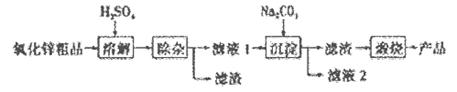

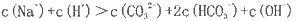
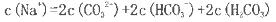
 (NxOy)+ H2O(配平时x、y用具体数值表示,物质填在
(NxOy)+ H2O(配平时x、y用具体数值表示,物质填在 TiO2+H2O
TiO2+H2O