题目内容
下列各组给定原子序数的元素,能形成原子数之比为1∶1稳定化合物的是( )
① 1和6 ② 7和8 ③ 8 和 12 ④ 12和17 ⑤ 20和35
| A.①②④ | B.②③⑤ | C.①②③ | D.③④⑤ |
C
解析试题分析:①能形成C6H6等物质,②能形成NO③能形成MgO④形成的化合物为MgCl2⑤形成CaBr2,故C正确。
考点:考查原子结构,化合价等相关知识。

练习册系列答案
相关题目
如图是元素周期表的一部分,下列关系正确的是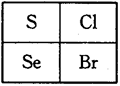
| A.还原性:Se2->S2->Cl- |
| B.热稳定性:HCl>H2Se>HBr |
| C.原子半径:Se>Cl>S |
| D.酸性:HBrO4>HClO>H2SO4 |
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。甲的化学式为YX3,是一种刺激性气味的气体,乙是由X、Y、Z组成的盐。下列说法正确的是
| A.原子半径:W>Y>Z,简单离子半径: Y>Z>W |
| B.YX 3的空间构型是三角锥型,而Y2X4的空间构型类似于乙烯的空间构型 |
| C.测得乙的水溶液呈酸性,则溶液中乙盐阳离子浓度大于酸根离子浓度 |
| D.W的氯化物熔点低,易升华,但水溶液能导电,由此推断它属于弱电解质 |
下表列出了A~G7种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | C | D | E | | |
| 3 | | | B | | | | F | G |
| 4 | A | | | | | | | |
(1)分别写出A、D、G的元素符号: 、 、 ,其中化学性质最不活泼的是 (填元素符号);
(2)F的氢化物中化学键的类型是 ,F的最高价氧化物对应的水化物的化学式是 ;
(3)C、D、E三种元素中,氢化物种类最多的是 ;
(4)写出B与F形成的化合物发生水解反应的离子方程式 ;
W、X、Y、Z是原子序数依次增大的四种短周期元素,化合物WX能抑制水的电离。化合物Y2Z能促进水的电离,则Y元素是
| A.Na | B.F | C.Li | D.Cl |
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是
| A.原子半径:Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
X、Y、Z、W为四种短周期主族元素。其中X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是( )
| A.Y、Z两元素的简单离子的半径Y>Z |
| B.Y元素最高价氧化物对应水化物的化学式为H2YO4 |
| C.原子序数由小到大的顺序为W<X<Y<Z |
| D.X与W可以形成W2X、W2X2两种化合物 |