题目内容
用二氧化锰和足量浓盐酸反应制取氯气,当有4molHCl参加反应时,生成氯气的体积在标准状况下是
| A.11.2L | B.22.4L | C.33.6L | D.44.8L |
B
由反应MnO2+4HCl(浓)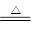 MnCl2+Cl2↑+2H2O可知,生成的氯气为1mol,即22.4L
MnCl2+Cl2↑+2H2O可知,生成的氯气为1mol,即22.4L
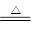 MnCl2+Cl2↑+2H2O可知,生成的氯气为1mol,即22.4L
MnCl2+Cl2↑+2H2O可知,生成的氯气为1mol,即22.4L
练习册系列答案
相关题目
题目内容
| A.11.2L | B.22.4L | C.33.6L | D.44.8L |
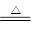 MnCl2+Cl2↑+2H2O可知,生成的氯气为1mol,即22.4L
MnCl2+Cl2↑+2H2O可知,生成的氯气为1mol,即22.4L