题目内容
在25℃时,用石墨电极电解1000mL一定浓度的CuSO4溶液.5min后电解完全,在一个石墨电极上只有1.28g Cu生成.试回答下列问题:
(1)电解总离子方程式反应式为
(2)得到的溶液的pH是
(3)在原CuSO4溶液中,如要生成Cu(OH)2沉淀,应调整溶液的PH为
(1)电解总离子方程式反应式为
2Cu2++2H2O=2Cu+O2+4H+
2Cu2++2H2O=2Cu+O2+4H+
.(2)得到的溶液的pH是
1.4
1.4
.(lg2=0.3)反应速率v(Cu2+):v(O2)=2:1
2:1
(3)在原CuSO4溶液中,如要生成Cu(OH)2沉淀,应调整溶液的PH为
5
5
(KspCu(OH)2=2×10-20)分析:(1)根据电解池的电解原理来书写电解反应方程式;
(2)根据阴极反应计算当有1.28g Cu生成时,反应所转移的电子数,两极上转移电子相等计算阳极上得到气体的物质的量以及溶液中含有的铜离子的物质的量,进而计算浓度;
(3)根据沉淀溶解平衡中的溶度积表达式进行计算即可.
(2)根据阴极反应计算当有1.28g Cu生成时,反应所转移的电子数,两极上转移电子相等计算阳极上得到气体的物质的量以及溶液中含有的铜离子的物质的量,进而计算浓度;
(3)根据沉淀溶解平衡中的溶度积表达式进行计算即可.
解答:解:(1)电解硫酸铜时,阳极上是氢氧根放电,阴极上是铜离子放电,电解原理方程式为:2CuSO4+2H2O=2Cu+O2↑+2H2SO4,离子方程式为:2Cu2++2H2O=2Cu+O2+4H+,故答案为:2Cu2++2H2O=2Cu+O2+4H+;
(2)电解硫酸铜时,阴极上是铜离子放电,即Cu2++2e-→Cu,当该电极上有1.28g Cu生成时,转移电子为
×2=0.04mol,消耗铜离子的物质的量是0.02mol,阳极上是氢氧根放电,即4OH-→O2↑+2H2O+4e-,当转移0.04mol电子时,则减少的氢氧根的浓度为0.04mol/L,生成氧气的物质的量是0.01mol,所以
反应速率v(Cu2+):v(O2)=2:1,电解后氢离子浓度为0.04mol/L,溶液的pH为2-2lg2=1.4,故答案为:1.4;2:1;
(3)在原CuSO4溶液中,铜离子的物质的量是0.02mol,浓度是0.02mol/L,如要生成Cu(OH)2沉淀,根据Ksp=c(Cu2+)?c(OH-)2得c(OH-)=
=
=10-9mol/L,应调整溶液的PH为5,故答案为:5.
(2)电解硫酸铜时,阴极上是铜离子放电,即Cu2++2e-→Cu,当该电极上有1.28g Cu生成时,转移电子为
| 1.28 |
| 64 |
反应速率v(Cu2+):v(O2)=2:1,电解后氢离子浓度为0.04mol/L,溶液的pH为2-2lg2=1.4,故答案为:1.4;2:1;
(3)在原CuSO4溶液中,铜离子的物质的量是0.02mol,浓度是0.02mol/L,如要生成Cu(OH)2沉淀,根据Ksp=c(Cu2+)?c(OH-)2得c(OH-)=
|
|
点评:本题考查学生电解原理以及溶度积的计算等有关知识,可以根据所学知识来回答,难度不大.

练习册系列答案
相关题目
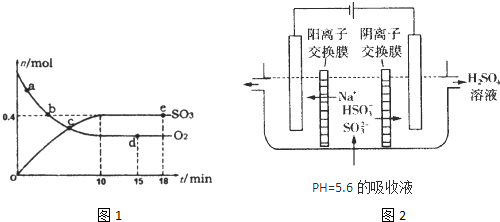
 Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。