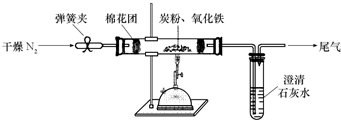
题目内容
亚硝酸钠(NaNO2)是一种既有氧化性又有还原性的盐,在酸性溶液中能氧化碘离子和亚铁离子,也能将人体内血红蛋白里的亚铁离子氧化为三价铁离子。亚硝酸钠常用于水泥施工的抗冻剂。由于它外观类似食盐,有咸味,易溶于水,在建筑工地上发生多起误把亚硝酸钠作食盐食用而导致民工中毒的事件。亚硝酸钠和酸反应生成亚硝酸,亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下分解反应:3HNO2====2NO↑+HNO3+H2O
从浓醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的物质作试剂,用两种简单的化学实验鉴别亚硝酸钠和氯化钠。试写出两种实验方法使用的试剂,并据此鉴别它们的现象。
(1)方法一(只用一种试剂)
试剂:____________,现象:_________________________________________。
(2)方法二
试剂:____________,现象:_________________________________________。
(1)浓醋酸 容器口有红棕色气体出现的原物质为NaNO2
(2)稀盐酸、碘化钾淀粉溶液 反应后溶液呈蓝色的原物质为NaNO2
解析:鉴别NaNO2和NaCl实质上就是检验![]() 和Cl-。检验Cl-常用AgNO3作试剂,但题中并未提供此试剂,故思考的重点应放在对
和Cl-。检验Cl-常用AgNO3作试剂,但题中并未提供此试剂,故思考的重点应放在对![]() 的检验上。本题提供NaNO2的信息有两条,一是可与酸反应生成HNO2,而HNO2只存在于冷的稀溶液中;二是NaNO2在酸性溶液中能氧化碘离子。为此,可选择以下两种方法:
的检验上。本题提供NaNO2的信息有两条,一是可与酸反应生成HNO2,而HNO2只存在于冷的稀溶液中;二是NaNO2在酸性溶液中能氧化碘离子。为此,可选择以下两种方法:
方法一:用浓醋酸。
方法二:用稀盐酸、碘化钾淀粉溶液。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目