题目内容
常温下,下列说法正确的是
| A.往CH3COOH溶液中加水,c(OHˉ)和c(H+)均增大 |
| B.物质的量浓度均为0.1mol?Lˉ1的CH3COOH溶液和NaOH溶液等体积混合,c(Na+)>c(CH3COOˉ) |
| C.某浓度的氯化铵溶液中存在c(NH4+)>c(Clˉ)>c(H+)> c(OHˉ) |
| D.在pH=4的氯化铵溶液中c(H+)+ c(NH4+)=" c(Clˉ)+" c(OHˉ) |
BD
解析试题分析:醋酸是弱酸,其溶液显酸性,加水稀释时溶液的酸性减弱,则溶液中c(H+)减小,但是水的离子积不变,则溶液中的c(OHˉ)增大,故A错误;混合后得到CH3COONa溶液,因为酸碱恰好完全中和,CH3COONa是强碱弱酸盐,钠离子不水解,醋酸根离子部分水解,则混和后溶液中c(Na+)>c(CH3COOˉ),故B正确;NH4Cl是强酸弱碱盐,其电离程度远远大于水,氯离子不能水解,铵根离子部分水解,消耗水电离出的氢氧根离子,使水的电离平衡右移,则c(Clˉ)>c(NH4+)>c(H+)>c(OHˉ),故C错误;氯化铵溶液中含有的离子有Clˉ、NH4+、H+、OHˉ,根据电荷守恒原理可知,c(H+)+c(NH4+)=" c(Clˉ)+" c(OHˉ),故D正确。
考点:考查水溶液中的离子平衡,涉及弱酸的稀释、水的离子积、溶液中离子浓度大小关系、电荷守恒原理等知识。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图6。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是
| A.a点:c(CO2-3)>c(HCO-3)>c(OH-) |
| B.b点:5c(Cl-)>4c(HCO-3)+4c(CO2-3) |
| C.c点:c(OH-)=c(H+)+c(HCO-3)+2c(H2CO3) |
| D.d点:c(H+)=2c(CO2-3)+c(HCO-3)+c(OH-) |
将体积为1mL,浓度为0.5mol/L的乙酸和体积为2mL,浓度为0.25mol/L的NaOH溶液混和,所得溶液中离子浓度由大到小的顺序是 ( )
| A.c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B.c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C.c(Na+)> c (OH-) > c(CH3COO-) >c(H+) |
| D.c(Na+)> c (OH-) > c(H+)> c(CH3COO-) |
室温时,向20mL 0.1mol·L-1的醋酸溶液中不断滴人0.1mol·L-1的NaOH溶液,溶液的pH变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
| A.a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) |
| B.b点时:c( Na+) ="c(" CH3COO-)>c(H+)="c(" OH-) |
| C.c点时:c(H+)=c(CH3COOH) +c( OH-) |
| D.d点时:c(Na+)>c(CH3COO -)>c(OH-)>c(H+) |
下列关于常温下电解质溶液的叙述中,正确的是
| A.碳酸氢按溶液和足量氢氧化钠溶液混合,反应的离子方程式为:HCO- 3+OH-=CO2- 3+H2O |
| B.25℃时,pH=8的0.lmol·L-1NaX溶液中由水电离出的c(OH-)=1×10-8mol·L-1 |
| C.等物质的量浓度的NH4Cl溶液和NH3·H2O溶液中,c(NH+ 4)前者小于后者 |
| D.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH+ 4)=c(Cl-)+c(OH-) |
25℃时,某氯化铵溶液pH=4,下列说法正确的是
| A.c(OH¯)=1×10¯10mol·L¯1 |
| B.c(NH4+)>c(Cl¯)>c(H+)>c(OH¯) |
| C.c(NH3·H2O)=c(NH4+) |
| D.c(H+)+c(NH4+)=c(Cl¯)+ c(OH¯) |
常温下,有下列四种溶液:
| ① | ② | ③ | ④ |
| 0.1mol/L NaOH溶液 | pH=11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3 CH3COOH溶液 |
下列说法正确的是
A.由水电离出的c(H+):③>①
B.③稀释到原来的100倍后,pH与④相同
C.①与③混合,若溶液pH=7,则V(NaOH)>V(CH3COOH)
D.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:c(CH3COOˉ)>c(H+)>c(Na+)>c(OHˉ)
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于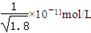 |
标准状态下,在四个干燥的烧瓶中分别充入:① 纯净的氨气,② 混有1/3体积空气的氯化氢气体,③ 纯净的NO2气体,④ 混有少量O2的NO2气体。然后各做喷泉实验。实验后,三烧瓶中溶液的物质的量浓度大小关系是
| A.①=②=③=④ | B.①=②=③>④ | C.①=②=③<④ | D.④>①=②>③ |